
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品.分析 (1)电解精制饱和食盐水生成氯气、氢气、烧碱;
(2)①酸的电离常数越大,酸的酸性越强,其阴离子结合氢离子能力越小,溶液的碱性越小;
②NaHSO3溶液中HSO3-的电离程度大于水解程度,则NaHSO3溶液呈酸性,故只要证明检验溶液呈酸性即可,可用pH试纸、酸碱指示剂完成;
(3)A.饱和氯水中存在HClO、水、氯气和水的反应的电离平衡;
B.根据溶液中电荷守恒分析判断;
C.往饱和氯水中加水,HClO的电离程度增大;
D.HClO不稳定,受热易分解;
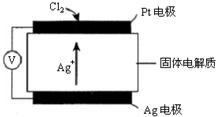
(4)Cl2在Pt电极放电,生成AgCl;
(5)控制条件使平衡正向移动,水解为吸热反应,所以加热平衡逆向移动;加水稀释,则水解平衡也正向移动;加入盐酸溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,平衡正向移动;
(6)作为消毒剂,还原产物都为-1价氯离子,每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,以单位质量的氧化剂所得到的电子数比值计算.
解答 解:(1)电解精制饱和食盐水的方法制取氯气、氢气、烧碱,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)①H2SO3的Ka1=1.54×10-2,Ka2=1.02×10-7;HClO的Ka=2.95×10-8,H2SO3的无论一级电离、二级电离都大于次氯酸的电离,所以NaClO溶液的水解程度大于亚硫酸钠,即碱性强于亚硫酸钠溶液,
故答案为:大于;
②NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7,
故答案为:用pH试纸(或pH计)测定NaHSO3溶液的酸碱性,测得溶液的pH<7;
(3)A.饱和氯水中存在平衡:Cl2+H2O?HCl+HClO,HClO?H++ClO-、H2O?H++OH-,故A错误;
B.溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数,[H+]=[Cl-]+[ClO-]+[OH-],故B正确;
C.Cl2+H2O?HCl+HClO,HClO?H++ClO-、往饱和氯水中加水,HCl浓度减小,C(H+)减少,促进次氯酸的电离,所以HClO的电离程度变大,故C错误;
D.夏季相比冬季温度高,HClO易分解,所以杀菌效果不如冬季,故D错误;
故选B;
(4)Cl2在Pt电极放电,生成AgCl,电极反应为:Cl2+2Ag++2e-=2AgCl,
故答案为:Cl2+2Ag++2e-=2AgCl;
(5)控制条件使平衡正向移动,使平衡正向移动,因为水解为吸热反应,所以加热,平衡正向移动;加水稀释,则水解平衡也正向移动;加入盐酸溶液为酸性,氢离子浓度增大,平衡逆向移动;加入碳酸氢钠,则消耗氢离子,所以氢离子浓度降低,平衡正向移动,故A、B、D符合条件,
故答案为:A、B、D;
(6)设质量都是71g,氯气得到的电子数为$\frac{71g}{71g/mol}$×2×1=2mol,
ClO2得到的电子数为$\frac{71g}{67.5g/mol}$×1×5=$\frac{71}{13.5}$mol,
则处理含CN-相同量的电镀废水,所需Cl2的质量是ClO2的比为:2.63:1=2.63,
故答案为:2.63.
点评 本题考查了氯碱工业有关知识,涉及电解、弱电解质的电离、盐类的水解,氧化还原有关计算等,主要是弱电解质电离程度大小和盐类水解的原理应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含12.0g NaHSO4的溶液中含氧原子数为0.4NA | |
| B. | 若铁溶于稀硝酸中,转移电子数为0.3NA,则溶解的铁一定是5.6g | |
| C. | 若0.1NA个N2分子体积为2.48L,则它的所处条件不是标准状况,质量是2.8g | |
| D. | N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,若放出46.2kJ热量,断裂H-H键数目大于1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于高分子化合物 | |
| B. | 能与Br2的CCl4溶液发生加成反应 | |
| C. | 常温下,是密度比水小的无色液体 | |
| D. | 每个分子中含有3个碳碳单键和3个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、加热(升华)、蒸发(结晶) | B. | 加热(升华)、溶解、过滤、蒸发(结晶) | ||
| C. | 升华、溶解、蒸馏、结晶 | D. | 溶解、结晶、过滤、升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2SO4溶液中,c(Na+):c(SO42-) | |
| B. | 相同温度下,0.2 mol/L CH3COOH溶液中c(H+)与0.1 mol/LCH3COOH溶液中c(H+) | |
| C. | 在密闭容器中,反应N2(g)+3H2(g)?2NH3 (g)已达平衡时的c(NH3)与c(N2) | |
| D. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小C或D的浓度 | B. | 减小B的浓度 | C. | 增大A或B的浓度 | D. | 减小A的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铜与浓硝酸反应能产生NO | |
| B. | 将CO2、SO2通入Ca(ClO)2溶液均发生反应且反应类型相同 | |
| C. | SiO2与所有的酸都不能发生反应 | |
| D. | 加过量盐酸产生能使澄清石灰水变浑浊气体的钠盐为Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com