
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是 ( )
A. 向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B. 新制氯水使红色布条褪色(HCl)
C. 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D. 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
科目:高中化学 来源: 题型:
NH3极易溶于水,与此性质无关的是
A.NH3与水形成分子间氢键
B.NH3是极性分子
C.NH3相对分子质量小,范德华力小
D.NH3会与水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.铁溶于稀硫酸中:2Fe +6H+=2Fe3++3H2↑
+6H+=2Fe3++3H2↑
B.二氧化硫与足量烧碱溶液反应:SO2+2OH-=SO32-+H2O
C.醋酸溶液与氢氧化钠溶液反应:H++OH-=H2O
D.浓盐酸与MnO2反应制Cl2:MnO2+2H++2C1-  C12↑+Mn2++H2O
C12↑+Mn2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸盐广泛用作氧化剂、皮革制作等。以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、 SiO2等杂质)为原料制取重铬酸钠的流程如下:
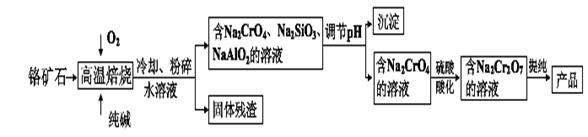 请回答下列问题:
请回答下列问题:
(1)写出Cr2O3与纯碱在高温焙烧时反应的化学方程式 ;
(2)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。
①该水样的COD为 mg/L;
②假设上述反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3 +沉淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是_ .
(可能用到的数据:KSPFe(OH)3=4.0×10-38, KSPCr(OH)3=6.0×10-31,
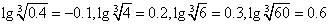
(3)在Na2Cr207溶液中加入固体KC1进行复分解反应即可制得橙色的K2Cr207。
重铬酸盐在酸性溶液中是强氧化剂,在加热时可氧化HBr和HC1,在这些反应中,重铬酸盐的还原产物是绿色Cr3+的盐,写出重铬酸钾与浓盐酸反应的离子方程式:
。
为验证卤素单质氧化性的相对强弱,某化学兴趣小组用下图所示装置进行试验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为橙色时,夹紧弹簧夹。
Ⅲ.当B中溶液橙色变深时,关闭活塞a。
Ⅳ.………
① 验证氯气的氧化性强于碘的实验现象是 。
②为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
③过程Ⅲ实验的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。下列关于In的说法中,错误的是( )
A.  In原子核外有49个电子 B.
In原子核外有49个电子 B. 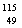 In原子核内有49个中子
In原子核内有49个中子
C. 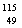 In原子核内质子数和中子数之和为115 D.
In原子核内质子数和中子数之和为115 D. 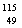 In是In元素的一种核素
In是In元素的一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
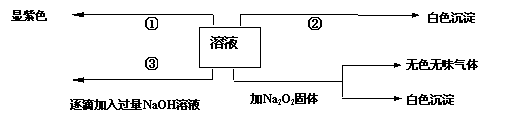
有一无色溶液,可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
|
|
|
白色沉淀
在第③个实验中,生成白色沉淀的量与加入NaOH的量有右图
所示的相互关系。据此可知:
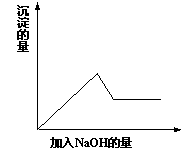 ⑴在原溶液中一定不存在的离子有_____________________。
⑴在原溶液中一定不存在的离子有_____________________。
⑵为满足该溶液中一定存在的离子的要求,一般可溶解两
种常见物质为(写化学式)___________和_________。
⑶写出第③个实验中发生反应的离子方程式
____________________ ___ ___
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性HSO3->I-,氧化性IO3->I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是

A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I-与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是( )
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H-的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com