
下列有关AgCl沉淀的溶解平衡的说法中,不正确的是
A.AgCl沉淀生成和溶解不断进行,但速率相等
B.AgCl难溶于水 ,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
在xR2++yH++O2=mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+,判断正确的是
A.m=y,R3+是还原剂 B.m=4,R2+是还原剂
C.m=2,R3+是氧化剂 D.m=2y,R2+被氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考二化学卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂物质的量之比为1:2的是
A.3S+6NaOH==2Na2S+Na2SO3+3H2O
B.2CH3COOH+Ca(ClO)2==2HClO+Ca(CH3COO)2
C.I2+2NaClO3==2NaIO3+Cl2
D.4HC1(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上11月月考化学卷(解析版) 题型:选择题
金属离子和硫离子在水溶液中的反应比较复杂,其产物和离子的水解、金属硫化物的的溶解度、离子氧化性或还原性等因素有关.资料表明,CuS的溶解度很小,在稀酸溶液中也不溶解;Ag2S的溶解度更小,但却溶于稀酸.下列有关说法正确的是( )
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.Al3+和S2-在水溶液中发生相互促进水解,所以不存在Al2S3的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+和H2S
D.在酸性溶液中,将S2-加入Ag+和Cu2+的混合液中Ag2S先沉淀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上11月月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小6 e; U5 G" b0 F5 ]
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变5 I0 d7 L- b% ?5 \3 L/ I8 ]8 U
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:实验题
某工厂废水中含游离态氮,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol·L-1的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是______________。
(2) 步骤②应使用___________式滴定管。
(3)试描述滴定终点的现象:___________________________。
(4)若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为______________。
(5)请指出实验中的一处明显错误:_________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10ml0.01mol·L-1 NaHC2O4溶液中滴加0.01mol•L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2mol•L-1
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol•L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密二中高二上期中化学试卷(解析版) 题型:填空题
白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热。
① P4(s,白磷)+
P4(s,白磷)+ O2(g)=
O2(g)= P4O10(s) ΔH1=-745.8 kJ·mol-1
P4O10(s) ΔH1=-745.8 kJ·mol-1
②4P(s,红橉)+5O2(g)=P4O10(s) ΔH2=-2954 kJ·mol-1
(1)白磷和红磷的关系是_____________。
a.同一种物质 b.同位素 c.同分异构体 D.同素异形体
(2)红磷的燃烧热是________kJ·mol-1,白磷 的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
(3)白磷转化为红磷的热化学方程式为P4(s,白磷)=4P(s,红磷)ΔH=-29.2 kJ/mol。在相同的条件下,能量较低的是________(填“白磷”或“红磷”),白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等。
(1)下列ΔH表示物质标准燃烧热的是___________;表示中和反应反应热的是___________。(填“ΔH1”、“ΔH2”、“ΔH3”等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+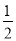 O2(g)===CO(g) ΔH2=-Q1
O2(g)===CO(g) ΔH2=-Q1 kJ·mol-1
kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4=-Q2kJ·mol-1
E.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH5
(2 )2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
)2.00 g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6 kJ的热量,写出该反应的热化学方程式:_________________。
(3)根据题(1)中 B、D判断1 molCO(g)完全燃烧的ΔH= 。
B、D判断1 molCO(g)完全燃烧的ΔH= 。
(4)反应E的ΔH6可以用如图所示的装置进行测量。实验中直接测定的数据是  ;
;

从实验装置上看,图中尚缺少的一种玻璃用品是_____________;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值___________(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com