
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
分析 A.pH=2的溶液呈酸性,可生成弱电解质或气体;
B.Br-不能大量存在的溶液具有强氧化性或含有Ag+等;
C.c(H+)=10-12mol•L-1的溶液呈碱性;
D.与Fe3+反应的离子不能大量共存.
解答 解:A.pH=2的溶液呈酸性,酸性条件下S2-不能大量共存,故A错误;
B.Br-不能大量存在的溶液具有强氧化性或含有Ag+等,如为强氧化性,则Fe2+不能大量共存,如含有Ag+,则Cl-不能大量共存,故B错误;
C.c(H+)=10-12mol•L-1的溶液呈碱性,碱性条件下,离子之间不发生任何反应,可大量共存,故C正确;
D.SCN-与Fe3+发生络合反应而不能大量共存,故D错误.
故选C.
点评 本题考查了离子共存,为高考常见题型,题目难度中等,明确离子反应发生条件为解答关键,注意掌握题干暗含条件的含义,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| B. | 将lmol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe在少量Cl2中燃烧生成FeCl2 | |
| B. | 蛋白质的盐析和变性均是化学变化 | |
| C. | 化学反应的焓变与反应物和生成物的状态无关 | |
| D. | 按a、b两种途径由铜制备相同量的硝酸铜,途径a、b消耗的铜一样多 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2;途径b:Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
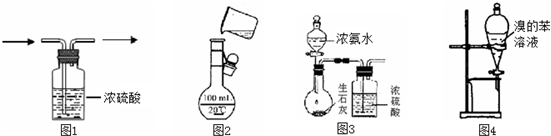
| A. | 图1用于除氯气中的水蒸气 | B. | 图2进行溶液的定容 | ||
| C. | 图3用于制取干燥的氨气 | D. | 图4用于溴与苯的分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
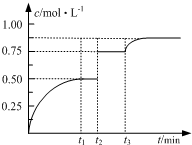 一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+B(g)?2C(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 若t1=2min,则υ(A)=0.50mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H<0 | |
| C. | 若t1时刻后向体系中再充入A、B、C各1mol,则υ(正)>υ(逆) | |
| D. | 保持温度不变,起始时向该容器中充入1molA和1molB,加入2molD,则达平衡时A的转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将H2O2滴入酸性KMnO4溶液中:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O | |
| B. | 碳酸氢铵溶液和足量氢氧化钠溶液混合并加热:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| C. | 用惰性电极电解氯化钠溶液:2 H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 1mol•L-1的NaAlO2溶液和2.5 mol•L-1的盐酸等体积混合:2 AlO2-+5 H+=Al(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 主要操作方法 |
| A | 溴苯 | 苯 | 加入铁粉和溴,过滤 |
| B | 氯化钠 | 氯化铵 | 加热 |
| C | 正丁醇,沸点117.7℃ | 乙醚,沸点34.5℃ | 蒸馏 |
| D | 乙酸乙酯 | 乙酸 | 加入饱和碳酸钠溶液,分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
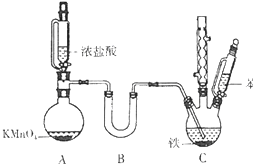 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):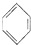 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$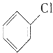 +HCl
+HCl| 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 苯 | 80.1 | 0.88 | 难溶于水 |
| 氯苯 | 132.2 | 1.10 | 难溶于水,易溶于有机溶剂 |
| 对二氯苯 | 173.4 | 1.46 | 难溶于水,易溶于有机溶剂 |
| 邻二氯苯 | 180.4 | 1.30 | 难溶于水,易溶于有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com