
兰尼镍(Rancy-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、氢化反应的催化剂。其高催化活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
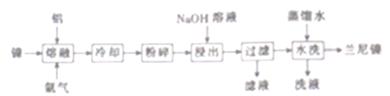
(1)“熔融”时通入氩气的目的是_____________________________________。
(2)“浸出”是整个流程的核心步骤,该步骤的目的是_____________________,发生反应的离子方程式为____________________________________。浸出反应所用NaOH溶液的浓度需达5mol·L-1以上,若用NaOH稀溶液浸出时,则会产生Al(OH)3沉淀阻止浸出反应持续进行,产生Al(OH)3的化学方程式为___________________________。
(3)滤液的主要成分与过量CO2反应的离子方程式为__________________。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是________________________。
【知识点】物质的分离和提纯,物质的基本性质 C2 C5
【答案解析】(1)防止Ni、Al被空气氧化(1分)
(2)除去合金中大部分的铝,形成多孔结构便于吸附氢气(1分);
2Al+2OH-+2H2O=2AlO2-+3H2↑(2分);2Al+6H2O=2Al(OH)3+3H2↑(2分)
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)
(4)新制兰尼镍的多孔结构中吸附大量浸出时产生的氢气(1分)
解析:(1)铝和镍在加热进行熔融时防止和空气中的氧气发生反应,必须通入惰性气体进行保护。
(2)在“浸出”时加入的氢氧化钠与原料中的铝发生反应而除去铝,发生的反应为2Al+2OH-+2H2O=2AlO2-+3H2↑;当碱液浓度比较小时,铝即可以和水发生反应生成氢氧化铝而阻止浸出反应持续进行。
(3)滤液中含有NaAlO2,故与过量CO2反应时生成Al(OH)3↓和NaHCO3。
(4)题目中提示镍的多孔结构对氢气具有强吸附性,在制取过程中产生的氢气被镍吸附,故在氢化时不需要加入氢气即可完成。
【思路点拨】本题考查了金属铝的性质,以信息的形式得到金属镍的强吸附性能,难度不大。


科目:高中化学 来源: 题型:
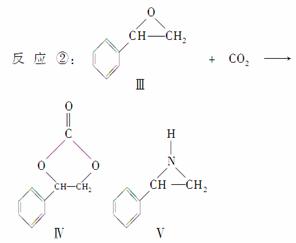
)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。CO2与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
反应①:
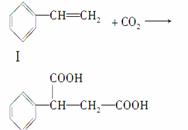
Ⅱ
(1)化合物Ⅰ的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)由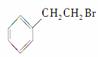 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为
________________________________________________________________________
________________________________________________________________________(注明反应条件)。
(3)Ⅱ与过量C2H5OH在酸催化下发生酯化反应,生成的有机物的结构简式为
________________________________________________________________________。
(4)在一定条件下,化合物Ⅴ能与CO2发生类似反应②的反应,生成两种化合物(互为同分异构体),请写出其中任意一种化合物的结构简式: __________________________
________________________________________________________________________。
(5)与CO2类似,CO也能被固定和利用。在一定条件下,CO、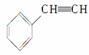 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有________________(双选,选字母)。
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应,下列关于Ⅵ和Ⅶ的说法正确的有________________(双选,选字母)。
A.都属于芳香烃衍生物
B.都能使溴的四氯化碳溶液褪色
C.都能与Na反应放出H2
D.1 mol Ⅵ或Ⅶ最多能与4 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、Cl、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
.现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
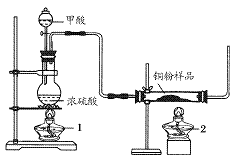
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系。下列有关物质的推断正确的是
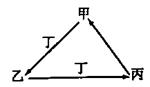
A.若甲为N2,则丁可能是O2
B.若甲为Fe,则丁可能是Cl2
C.若甲为AlCl3,则丁可能是NH3
D. 若甲为NaHCO3,则丁可能是HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z | |
| ① | 氨水 | Al(OH)3 | 氢氧化钠溶液 |
| ② | KOH | SiO2 | 氢氟酸 |
| ③ | 从 | SO2 | BaCl2溶液 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
A.2:4:1 B.3:2:1 C.2:3:1 D.4:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱质子理论,下列说法不正确的是(C)
A. 所有的弱酸根都是碱
B. 酸式弱酸根既是酸又是碱
C. 一种物质不可能既是酸又是碱
D. 氢氧根是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米氧化铝在陶瓷、电子、生物医药等方面有广泛的用途,它可通过硫酸铝铵晶体热分解得到.制备硫酸铝铵晶体的实验流程如下: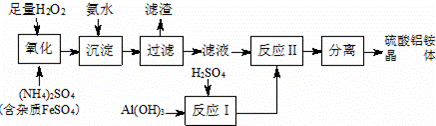
(1)H2O2氧化FeSO4的离子方程式为 2Fe2++H2O2+2H+=2Fe3++2H2O .
(2)加入氨水的目的是 Fe3+使转化为Fe(OH)3 ,其化学反应方程式为 Fe2(SO4)3+6NH3•H2O=2Fe(OH)3↓+3(NH4)2SO4 .
(3)若要保证产品的纯度,必须检验加入氨水后杂质是否除尽?其实验操作是:用试管取少量洗涤液, 加几滴KSCN溶液,若溶液不变红色 ,则说明滤渣已洗净.
(4)上述流程中,“分离”所包含的操作依次为: 蒸发浓缩 、 冷却结晶 、过滤、洗涤、干燥;请完成硫酸铝铵晶体高温分解的化学
方程式:2Al2(NH4)2(SO4)4•24H2O 2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
2 Al2O3+ 4 NH3↑+ 8 SO3↑+ 26H2O .
(5)取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.请计算确定400℃时(硫酸铵未分解)剩余固体成分的化学式为 (NH4)2Al2(SO4)4•H2O (不必写出计算过程).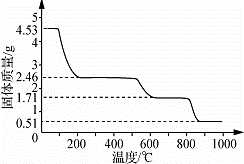
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com