
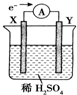
 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 溶液中,SO42-朝Y极移动 | |
| B. | 若两电极分别为铁和碳棒,则X为碳棒,Y为铁 | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序为X>Y |
分析 根据图片知,该装置是原电池,根据电子的流向判断正负极,电解质溶液中阴离子移向负极;较活泼的金属作负极,不活泼的金属或导电的非金属作正极;负极上发生氧化反应,正极上发生还原反应.
解答 解:A.根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,X为原电池的负极,电解质溶液中阴离子移向X极,故A错误;
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,故B错误;
C.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,故C错误;
D.原电池中较活泼的金属作负极,较不活泼的金属作正极,该原电池中X是负极,Y是正极,所以它们的活动性顺序为X>Y,故D正确;
故选D.
点评 本题考查了原电池原理,难度不大,会根据电子的流向判断原电池的正负极是解本题的关键,明确正负极的判断方法、正负极上发生反应的类型、电子和电解质溶液中的离子运动方向即可解答本题.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 2-甲基丁烯 | D. | 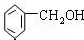 苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
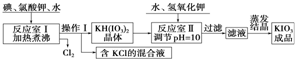
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式为2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O | |
| B. | 该反应中的氧化剂是H2O2,还原产物是O2 | |
| C. | 氧化性:H2CrO4>O2 | |
| D. | 如反应转移了0.3 rnol电子,则产生的气体在标准状况下体积为3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O 31P 35Cl | B. | 27Al 19F 12C | ||
| C. | 第一周期所有元素的原子 | D. | 元素周期表中ⅤA所有元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1 NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com