
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动;
③某温度下,平衡浓度符合:c(CO2)•c(H2)=c(CO)•c(H2O),则平衡常数K=1;
(2)①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
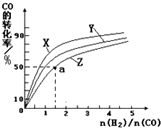
②n(H2):n(CO)的起始组成比一定条件下,正反应为放热反应,升高温度平衡逆向移动,CO转化率减小;
a点平衡时CO转化率为50%,CO起始物质的量为1mol,氢气起始物质的量为1.5mol,转化的CO为0.5mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 1.5 0
变化量(mol):0.5 1 0.5
平衡量(mol):0.5 0.5 0.5
再根据K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数.
解答 解:(1)①CO2(g)+H2(g)?CO(g)+H2O(g)的化学平衡常数K=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$,
故答案为:$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$;
②由表中数据可知,随温度升高平衡常数增大,说明升高温度平衡正向移动,而升高温度平衡向吸热反应移动,故答案为:吸热;
③某温度下,平衡浓度符合:c(CO2)•c(H2)=c(CO)•c(H2O),则平衡常数K=1,故温度为830℃,
故答案为:830;
(2)①A.随反应进行混合气体物质的量减小,恒温恒容下,容器内压强减小,体系压强保持不变,说明到达平衡,故A正确;
B.混合气体总质量不变,容器的溶容积不变,混合气体的密度始终不变,故B错误;
C.平衡时物质的浓度与起始浓度及转化率有关,平衡时CO与H2的浓度之比不一定等于化学计量数之比,故C错误;
D.单位时间内,消耗2molH2的同时消耗1molCH3OH,说明甲醇的生成速率与消耗速率相等,反应到达平衡,故D正确,
故选:AD;
②n(H2):n(CO)的起始组成比一定条件下,正反应为放热反应,升高温度平衡逆向移动,CO转化率减小,曲线Z对应CO转化率最小,温度最高,故对应的温度为270℃;
a点平衡时CO转化率为50%,CO起始物质的量为1mol,氢气起始物质的量为1.5mol,转化的CO为0.5mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 1.5 0
变化量(mol):0.5 1 0.5
平衡量(mol):0.5 0.5 0.5
容器的体积为1L,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.5mol/L}{0.5mol/L×(0.5mol/L)^{2}}$=4(mol/L)-2,
故答案为:270℃;4(mol/L)-2.
点评 本题考查化学平衡计算与影响因素、平衡常数、化学平衡图象等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
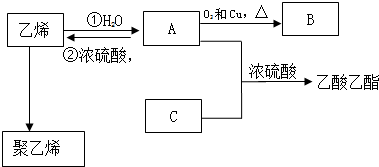
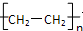 ,化合物C所含官能团的名称为羧基.
,化合物C所含官能团的名称为羧基.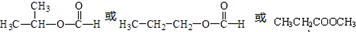 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在用塑料塞的玻璃瓶中 | |
| B. | 液溴盛放在用橡胶塞的玻璃瓶中 | |
| C. | 氯水贮存于棕色玻璃瓶中,密闭保存于阴凉处 | |
| D. | 硅酸钠溶液密封保存在玻璃塞的玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
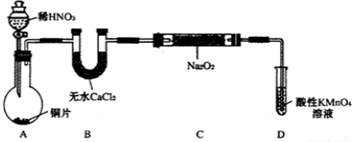
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡, 再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com