
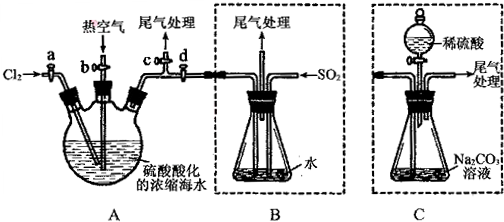
分析 (1)实验室制备氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(2)溴易挥发,步骤②中鼓入热空气把A中生成的溴蒸气排出到B中;
(3)二氧化硫具有还原性,把单质溴还原为溴离子;
(4)溴、氯气和二氧化硫都有毒,可用碱液吸收;
(5)根据蒸馏所需仪器回答;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,化合价升降总数相等和原子守恒配平方程式;
(7)采用C装置,步骤少,减少了二氧化硫的污染.
解答 解:(1)实验室制备氯气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br2,
故答案为:使A中生成的Br2随空气流进入B中;
(3)二氧化硫具有还原性,把单质溴还原为溴离子,反应的方程式为Br2+SO2+2H2O═4H++2Br-+SO42-;
故答案为:Br2+SO2+2H2O═4H++2Br-+SO42-;
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,不能直接排空,且这几种物质都能和碱反应,所以用碱液吸收;
故答案为:c;
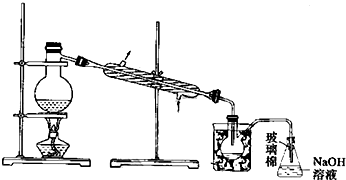
(5)蒸馏需要蒸馏烧瓶、冷凝管、酒精灯、温度计、牛角管和锥形瓶等;达到提纯溴的目的,操作中应控制的关键条件是把温度控制在溴的沸点59°C,并收集该温度下的馏分,步骤⑤中,用图2所示装置进行蒸馏,收集液溴,装置图中缺少的必要仪是温度计和水浴,将装置图中缺少的必要仪器补画出来装置图为: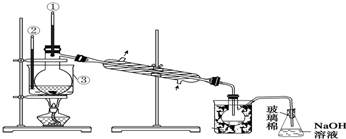
故答案为: ;
;
(6)根据题给信息,溴和碳酸钠反应生成了溴化钠和溴酸钠,据此写出反应方程式为:Br2+Na2CO3→NaBr+NaBrO3,根据化合价升降总数相等配平为:3Br2+3Na2CO3→5NaBr+NaBrO3,根据原子守恒,还有产物二氧化碳3mol,故反应方程式为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(7)采用C装置,步骤少,减少了二氧化硫的污染,
故答案为:操作简单,污染小.
点评 本题结合海水提取溴的过程,考查了实验基本操作、实验方案的评价、氧化还原反应方程式的书写,在配平时抓住化合价升降总数相等,题目难度中等.


科目:高中化学 来源: 题型:实验题
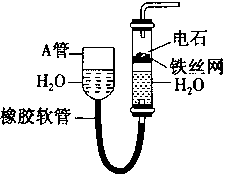 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4比CH4稳定 | |
| B. | P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱 | |
| C. | Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强 | |
| D. | O2-半径比F-的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 晚上发生的是放热反应 | B. | 白天将化学能转化为太阳能 | ||
| C. | 晚上将化学能转化为热能 | D. | 此法可减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①②⑤⑧ | C. | ②③⑦ | D. | ②⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com