
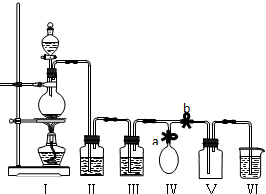
分析 实验室用加热二氧化锰与浓盐酸的方法制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,要得到干燥纯净的氯气,应依次通过盛有饱和食盐水和浓硫酸的洗气瓶分别除去氯化氢和水蒸气,氯气密度大于空气密度,采用向上排气法收集,氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用盛有氢氧化钠溶液吸收过量的氯气.
(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,依据反应方程式中氯元素化合价变化判断盐酸的作用;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入集气瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用盛有氢氧化钠溶液吸收过量的氯气.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,离子方程式:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O,依据方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知参加反应的氯化氢有4mol,只有2mol氯离子化合价升高,另外2mol氯离子化合价不变,所以浓盐酸既表现酸性又表现还原性;
故答案为:MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2+2H2O;酸性和氧化性;
(2)浓盐酸制取的氯气中含有氯化氢气体和水蒸气,为防止干扰实验,氯气在进入集气瓶前,应该用饱和食盐水和浓硫酸分别除去氯化氢和水蒸气;
故答案为:除HCl; 浓H2SO4;
(3)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-═Cl-+ClO-+2H2O,可以用盛有氢氧化钠溶液吸收过量的氯气;
故答案为:NaOH溶液; Cl2+2OH-═Cl-+ClO-+2H2O.
点评 本题考查了实验室制备氯气的方法和原理分析,氯气性质的分析应用,掌握基础是关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学能转化成光能 | B. | 化学能转化成电能 | ||
| C. | 光能转化成化学能 | D. | 电能转化成光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
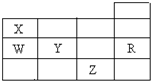
| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | W的氢化物比X的氢化物稳定 | |
| D. | Y元素最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
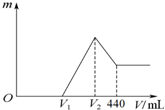
| A. | V2=400mL | |
| B. | 0≤V1<280mL | |
| C. | 加入NaOH溶液的过程中,产生沉淀的最大量可能为0.18mol | |
| D. | 当V1=160mL时,n(Mg)=0.04mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | 温度为298 K时,pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com