
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: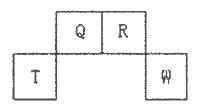
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为 (用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
(1)第三周期ⅥA族;Al>C>N;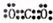 ;
;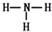 ;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
;(2)弱于;(3)低;(4)金刚石;(5)⑦;⑥。
解析试题分析:短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素;(1)W为S元素,原子核外有3个电子层,最外层电子数为6,处于周期表中第三周期ⅥA族;同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N;Q的最高价氧化物为CO2,分子中碳原子与氧原子之间形成2对共用电子对,其电子式为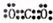 ;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为
;R气态氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,其结构式为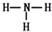 ,故答案为:第三周期ⅥA族;Al>C>N;
,故答案为:第三周期ⅥA族;Al>C>N;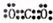 ;
;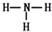 ;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
;(2)非金属性S>C,故的电子能力S>C,故答案为:弱于;
(3)原子序数比R多8的元素形成的一种常见气态氢化物为PH3,PH3分子之间为范德华力,NH3分子之间存在氢键,最大分子间作用力,故PH3沸点低于NH3,故答案为:低;(4)四元素单质中属于原子晶体的是金刚石,故答案为:金刚石;(5)R为氮元素,最高化合价为+5、最大化合价为-3,原子半径小于P,故为⑦号元素;与Al同周期且最高价氧化物的水化物碱性最强的元素为Na,最后化合价为+1,短周期中原子半径最大,故为⑥号元素,故答案为:⑦;⑥。
考点:考查元素周期表与元素周期律的总和应用。


科目:高中化学 来源: 题型:填空题
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | ③ | ④ | |
| 三 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg Al | O S | MgO MgS | H2O H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 。
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 。简述你的判断依据
。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体。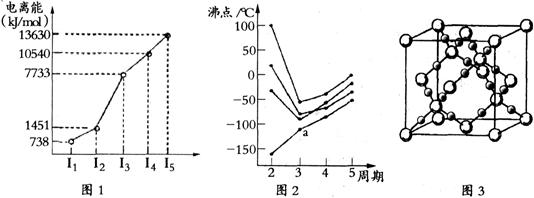
(4)BCl3原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有
种。写出与BCl3结构相同的一种等电子体(写离子) 。
(5)Cu元素形成的单质,其晶体的堆积模型为______,D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是________ (填选项序号)。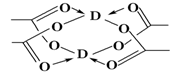
①极性键 ②非极性键 ③配位键 ④金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。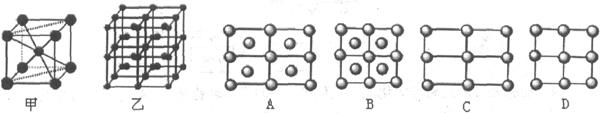
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱金属元素在科学研究与生产生活中有着非常广泛的用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: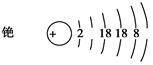
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈, | B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解, | D.其碳酸盐易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下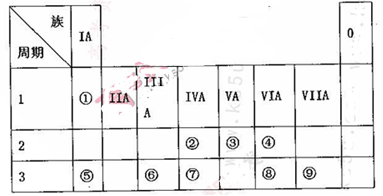
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共12分)
沸石是一大类天然结晶硅铝酸盐的统称。自然界中已发现的沸石有30多种,较常见的有方沸石NaAlSi2O6·H2O、钠沸石Na2Al2Si3O10·2H2O和钙沸石CaAl2Si3O10·3H2O等。
完成下列填空:
23.钠原子核外共有 种不同能量的电子,这些电子分占 种不同的轨道。
24.常温下,下列5种钠盐浓度均为0.1mol·L-1的溶液,对应的pH如下:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com