
分析 设混合气体中甲烷、氢气的物质的量分别为x、y,根据“完全燃烧后生成CO2的质量刚好等于原混合气体的质量”及“完全燃烧后消耗了等体积的氧气”列式计算即可.
解答 解:设混合气体中甲烷、氢气的物质的量分别为x、y,甲烷燃烧生成二氧化碳的物质的量为x,
根据“完全燃烧后生成CO2的质量刚好等于原混合气体的质量”可知:16x+2y=44x,整理可得:x:y=14,相同条件下气体的体积之比等于物质的量之比,则此混合气体中甲烷和氢气的体积比是1:14;
根据“完全燃烧后消耗了等体积的氧气”及相同条件下气体的体积之比等于物质的量之比可知,2x+0.5y=x+y,整理可得:1:2,
则此混合气体中甲烷和氢气的质量比=16:(2×2)=4:1,
故答案为:1:14;4:1.
点评 本题考查了混合物反应的计算,题目难度中等,明确物质的量与摩尔质量、气体摩尔体积等之间的关系为解答关键,试题侧重考查学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
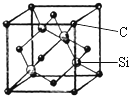 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
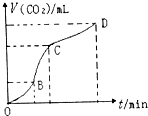 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )| A. | CD段二氧化碳气体的体积小于BC段二氧化碳气体的体积 | |
| B. | 在OB、BC、CD三段中,BC段的反应速率最快,原因是该反应放热,温度在BC段起主要作用 | |
| C. | 相同条件下,向上述反应的溶液中加入NaCl溶液可降低化学反应的速率 | |
| D. | OB段反应物浓度大,所以OB段反应速率最快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
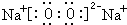 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
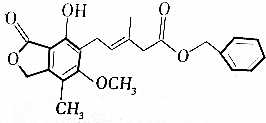
| A. | 该物质的化学式是C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2加成 | |
| C. | 酸性KMnO4溶液、溴水能与该物质发生氧化还原反应而褪色 | |
| D. | 该物质与FeCl3溶液作用可显红色,该反应可用于检验其中的酚羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com