
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇分子中羟基上氢原子的活泼性 | 用质量相等、形状相近的金属钠分别与水和乙醇反应 |
| B | 鉴别乙烷和乙烯 | 分别将气体通入品红溶液 |
| C | 除去苯中混有的少量苯酚 | 加入足量的氢氧化钠溶液,充分振荡后分液 |
| D | 检验淀粉与稀硫酸加热后是否水解 | 加入少量新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠与水反应比与乙醇反应剧烈;
B.二者均与品红不反应;
C.苯酚与NaOH反应后,与苯分层;
D.水解后检验葡萄糖,应在碱性条件下.
解答 解:A.钠与水反应比与乙醇反应剧烈,该实验可比较羟基氢的活泼性,故A正确;
B.二者均与品红不反应,现象相同,不能鉴别,故B错误;
C.苯酚与NaOH反应后,与苯分层,然后分液可除杂,故C正确;
D.水解后检验葡萄糖,应在碱性条件下,则没有加碱至碱性,不能检验,故D错误;
故选BD.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、混合物分离提纯、有机物的鉴别和检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
 电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:
电离平衡、水解平衡、沉淀溶解平衡是溶液中的三大平衡.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+ | |
| D. | 实验室制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4是还原剂 | B. | HC1是氧化剂 | ||
| C. | HC1中的氯元素得到电子 | D. | KMnO4中的Mn元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在铜催化加热下可制得乙醚 | |
| B. | 淀粉在稀硫酸催化加热下可制得氨基酸 | |
| C. | 苯和乙烯在一定条件下反应可制得乙苯 | |
| D. | 乙苯与酸性高锰酸钾溶液反应生成苯乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$\stackrel{O_{2}点燃}{→}$NO2$\stackrel{H_{2}O}{→}$HNO2 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤和水煤气均是二次能源 | |
| B. | 煤的干馏为化学变化,煤的液化和气化为物理变化 | |
| C. | 煤中含有苯、甲苯、二甲苯等有机物 | |
| D. | 由水煤气转化为甲醇或乙酸时,原子利用率均达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
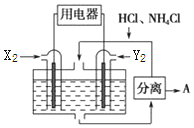
 如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)
如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com