
����Ŀ��ijͬѧ������ͼ��ʾ��ʵ��װ�ý�������ˮ������Ӧ��ʵ�飬�������о������仯����IJ������ʡ�
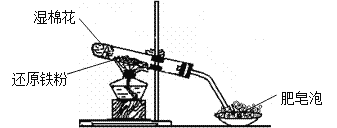
��ش��������⣺
��1��Ӳ���Թ��з�����Ӧ�Ļ�ѧ����ʽΪ____________________________ ��
��2����ͬѧ��ȷ����Ӧ��Ӳ���Թ��й������ʵijɷ֣����������ʵ�鷽����
�ٴ�Ӳ���Թ���ȴ��ȡ�������еĹ�����������ϡ�������ҺB��
��ȡ������ҺB�μ�KSCN��Һ������Һ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���______������Һδ���ɫ��˵��Ӳ���Թ��й������ʵijɷ���___________________________��
��3����ͬѧ������ʵ�鷽��������ʵ�飬�����Һδ���ɫ��ԭ���ǣ�__________�������ӷ���ʽ��ʾ����
��4����ͬѧ������ȡ������ҺB��ʹ���NaOH��Һ��Ӧ��������ͼ��ʾ�IJ������ɹ۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��������д��������������صķ�Ӧ�Ļ�ѧ����ʽ��_____________________ , _______________________��
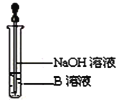
��5��һ��ʱ���ͬѧ���֣�3����δ������Һ��ɺ�ɫ��˵��Fe2+ ����_______�ԣ��ɴ˿�֪��ʵ������FeSO4��ҺҪ��ʱ���Ʋ����������۵�ԭ����___________________��
���𰸡� 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 һ����Fe3O4��������Fe Fe3O4��Fe Fe + 2Fe3+��3Fe2+ FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4 4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3 ��ԭ Fe2+ �ױ������е���������������
Fe3O4 + 4H2 һ����Fe3O4��������Fe Fe3O4��Fe Fe + 2Fe3+��3Fe2+ FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4 4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3 ��ԭ Fe2+ �ױ������е���������������
����������1��Ӳ���Թ��з����ķ�Ӧ�ǻ�ԭ������ˮ�����ڸ����µķ�Ӧ����Ӧ������Fe3O4��H2����ѧ����ʽΪ��3Fe + 4H2O(g) ![]() Fe3O4 + 4H2��
Fe3O4 + 4H2��
��2����Ӧ��Ӳ���Թ��еĹ���������һ������Fe3O4�����ܺ���δ��ȫ��Ӧ��Fe��������м���ϡ���ᣬһ�������ķ�Ӧ�У�Fe3O4+8H+=Fe2++2Fe3++4H2O�����ܷ����ķ�Ӧ�У�Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+������������ҺB�еμ�KSCN��Һ������Һ���ɫ����˵����Һ�к���Fe3+����ԭ���������п��ܲ���Fe��Ҳ���ܺ���������Fe������Һδ���ɫ��˵����Һ�в�����Fe3+�������ϡ�������Һ��һ�������ˡ�Fe+2Fe3+=3Fe2+����ԭ��Ϲ�����һ������Fe���ʴ�Ϊ��һ����Fe3O4��������Fe��Fe3O4��Fe��
��3����Һδ���ɫ����Ϊԭ��Ϲ����к���Fe���ʣ�Fe��Fe3+��ԭΪFe2+���Ӷ���Һ�в�����Fe3+����Ӧ�����ӷ���ʽΪFe + 2Fe3+��3Fe2+��
��4����ҺB��NaOH��Һ��Ӧ���۲쵽���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ����֪��ʼ����Fe(OH)2��Ȼ������ΪFe(OH)3����Ӧ�Ļ�ѧ����ʽΪ��FeSO4 + 2NaOH �� Fe(OH)2��+ Na2SO4��4Fe(OH)2 + O2 + 2H2O �� 4Fe(OH)3��
��5����3����δ������Һ��ɺ�ɫ��˵����Һ�е�Fe2+������ΪFe3+����Fe2+���л�ԭ�ԣ��ױ������е��������������ʣ����ʵ������FeSO4��ҺҪ��ʱ���Ʋ����������ۣ���Fe��Ŀ�ľ��ǽ��������ɵ�Fe3+��ԭΪFe2+�������ķ�ӦΪFe + 2Fe3+��3Fe2+���ʴ�Ϊ����ԭ��Fe2+ �ױ������е����������ʡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ���ʵ���(����)
A. �������� B. ���� C. ͭ D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���Ͷ������ˮ�У��ٵμӷ�̪����Һ�����Ϊ��ɫ���ǣ� ��
A.Na
B.Na2O
C.Na2CO3
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У����ۼ����ƻ����ǣ� ��
A. ������B. NaOH�ۻ�
C. NaHSO4����ˮD. �ƾ�����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ�������ж���ȷ���ǣ� ��
A.���³�ѹ�£�44gCO2�к��е���ԭ����ĿΪ2NA
B.��״���£�22.4LH2O���еķ�����ĿΪNA
C.1molL��1K2SO4��Һ�к��еļ�������ĿΪ2NA
D.1molFe��������Cl2����ȫȼ�գ�ת�Ƶĵ�����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1��3������2����ϩ�Ľṹ��ʽ����
��2��![]() ��ϵͳ����Ϊ��
��ϵͳ����Ϊ��
��3������ʽ ![]() ��ʾ�ķ���ʽΪ ��
��ʾ�ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2005��ŵ������ѧ�������ʩ�˵��˷��֣�������Ŀ��������������Ϊ�dz���Ч��ϩ�����ֽ��������ҵ��ұ����Ļ�ѧԭ��Ϊ�� ��
��2MoS2+7O2![]() 2MoO3+4SO2 ��MoO3+2NH3��H2O=��NH4��2MoO4+H2O
2MoO3+4SO2 ��MoO3+2NH3��H2O=��NH4��2MoO4+H2O
����NH4��2MoO4+2HCl=H2MoO4��+2NH4C1 ��H2MoO4 MoO3+H2O
���û�ԭ����MoO3��ԭ�ɽ����⡣������˵����ȷ����
A����Ӧ�������������û���Ӧ
B��MoO3���ڼ���������
C���ڷ�Ӧ����Mo��S��������
D������H2��CO�����ֱ�ԭ������MoO3�������Ļ�ԭ�������ʵ���֮��Ϊ2:2:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�������ȡ����Ӧ�ĸĽ�ʵ��װ��ͼ������AΪ�ɾ���֧�ܵ��Թ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ���������м�ۣ���д���пհף���ע���屽��NaOH��Һͨ�������²��ᷢ��ˮ�ⷴӦ�� 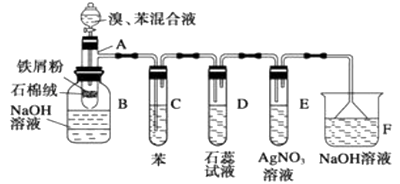
��1����Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A���������л���Ӧ�Ļ�ѧ����ʽ�����÷�Ӧ������Ϊ
��2����Ӧ��ʼ�۲�D��E���Թܣ�����������Ϊ D��
E��
��3���Թ�C�б��������� ��
��4������������װ���У����з��������õ������У�����ĸ���� ��
��5����Ӧ2��3min����B�е�NaOH��Һ��ɹ۲쵽�������� ��
��6���Ľ����ʵ����ٲ�����������㣬�ɹ��ʸߣ��ڸ����������ԣ��۶Բ�Ʒ���ڹ۲���3���ŵ��⣬����һ���ŵ��ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�ij��������������Һ���ΪV mL����Һ�ܶ�Ϊd g��cm��3����������Ϊw�����ʵ���Ũ��Ϊc mol��L��1����Һ�к��������Ƶ�����Ϊm g�����¶���NaOH���ܽ��ΪS��
��1����w����ʾ���¶����������Ƶ��ܽ��(S)Ϊ_________________��
��2����m��V��ʾ��Һ�����ʵ����ʵ���Ũ��(c)Ϊ__________________��
��3����w��d��ʾ��Һ�����ʵ����ʵ���Ũ��(c)Ϊ__________________��
��4����c��d��ʾ��Һ�����ʵ���������(w)Ϊ______________________��
��5����S��d��ʾ��Һ�����ʵ����ʵ���Ũ��(c)Ϊ___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com