
【题目】植物油厂想要提取大豆中丰富的油脂,下列方案设计合理的是( )
A.将大豆用水浸泡,使其中的油脂溶于水,然后再分馏
B.先将大豆压成颗粒状,再用无毒的有机溶剂浸泡,然后对浸出液进行蒸馏分离
C.将大豆用碱溶液处理,使其中的油脂溶解,然后再蒸发出来
D.将大豆粉碎,然后隔绝空气加热,使其中的油脂挥发出来
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因硬度大、熔点高、常温时耐酸碱腐蚀而被广泛应用。以钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工艺流程如图所示:
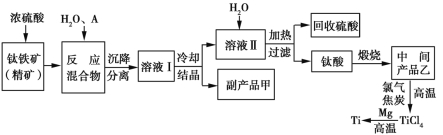
请回答下列问题:
(1)钛铁矿在酸浸前需进行粉碎处理,原因是 。
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
(3)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 。
(4)在溶液Ⅱ中加水并加热的目的是 。
(5)上述冶炼金属钛的过程中,可回收利用的物质是 。
(6)上述流程制得的金属钛中混有少量杂质,可加入 溶解除去。
(7)若钛铁矿中钛的含量为a%,整个流程钛的损耗率为b%,欲制造1 t金属钛,需要钛铁矿的质量为_____________t(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】
某高聚物W和树脂X的合成路线如下:
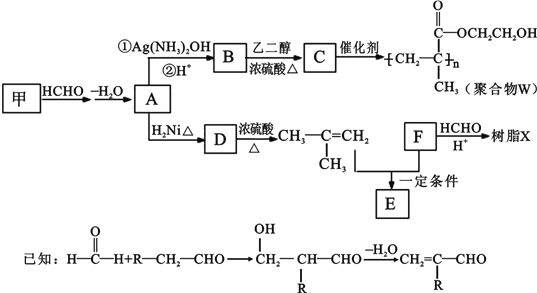
(1) A 的结构简式是_____。
(2) C中含氧官能团的名称是_____。
(3) D 的名称是_____。
(4) A→B 的第一步化学反应方程式是__
(5) 已知 F 的相对分子质量为 110,分子中碳原子、氢原子数都是氧原子数的 3 倍,苯环上的氢原子化学环境都相同,则 F 能发生的反应是(填字母)___。
a.加成反应 b.加聚反应 c.氧化反应 d.水解反应
(6) E 的分子式为 C10H14O2,含三个甲基,苯环上的一溴代物有两种。生成 E 的化学方程式是_____。
(7) B 有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有__种(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
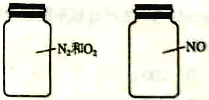
A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①20g NaOH溶于水形成500mL溶液,所得溶液的物质的量浓度是_________mol/L。
②标准状况下,44.8LNH3溶于水形成1L溶液,所得溶液的物质的量浓度是_____mol/L。
③配制500mL 0.5 molL-1的盐酸,需要标准状况下的HCl气体多少_____升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ]Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
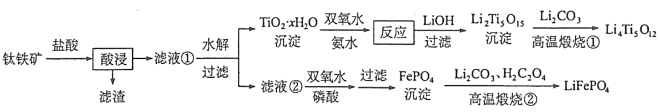
回答下列问题:
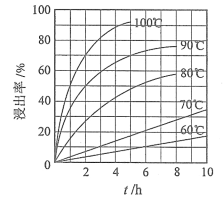
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式__________________。
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017·新课标III]重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
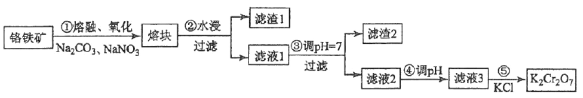
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
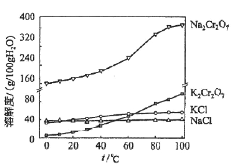
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,质量分数为w,其中含有NH![]() 的物质的量是b mol,下列叙述正确的是( )
的物质的量是b mol,下列叙述正确的是( )
A. 溶质的质量分数w=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol·L-1+c(H+)
mol·L-1+c(H+)
D. 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com