
分析 (1)根据浓盐酸试剂瓶标签数据计算出物质的量浓度;
(2)氧化剂:得到电子,化合价降低,被还原;
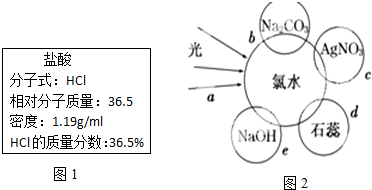
(3)①c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,e过程中的化学反应是氯水中的氯气和氢氧化钠发生反应生成氯化钠、次氯酸钠和水;
②氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色;b过程是氯水中的盐酸和碳酸钠反应生成二氧化碳气体证明了氯水中存在酸.
解答 解:(1)1L该浓盐酸中含有的氯化氢的质量为:$\frac{1.19×1000×36.5%}{36.5}$mol=11.9mol,该盐酸的物质的量浓度为:11.9mol/L,
故答案为:11.9;
(2)2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,
KMnO4中锰的化合价由+7价降低为+2价,化合价降低,故KMnO4为氧化剂,
故答案为:KMnO4;
(3)①c过程的反应是氯水中的盐酸和硝酸银反应得到氯化银沉淀,反应的化学方程式为:AgNO3+HCl=AgCl↓+HNO3,e过程中的化学反应是氯水中的氯气和氢氧化钠发生反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:AgNO3+HCl=AgCl↓+HNO3;Cl2+2NaOH=NaCl+NaClO+H2O;
②氯水中含有盐酸和次氯酸,盐酸具有酸性,次氯酸具有漂白性,d过程所观察到的现象是先变红色,后褪色;b过程是氯水中的盐酸和碳酸钠反应生成二氧化碳气体证明了氯水中存在酸,村长的微粒为H+,故选d,
故答案为:溶液先变红而后褪色;d.
点评 本题考查浓度计算、氧化还原反应概念分析、氯气的性质,题目难度不大,注意氯水的成分和性质,化学方程式书写,注重基础知识的积累.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.7g羟基所含电子数目为NA | |
| B. | 1L 1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2nNA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com