(2012?太原一模)氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
(CuCl
2?2H
2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl
2反应转化为固体1(部分仪器和夹持装置已略去).
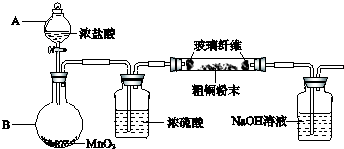
①仪器A的名称是
分液漏斗
分液漏斗
.
②装置B中发生反应的离子方程式是
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
.
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
否
否
.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
cd
cd
.
a.NaOH b.NH
3?H
2O c.CuO d.Cu
2(OH)
2CO
3 e.CuSO
4(3)在溶液2转化为CuCl
2?2H
2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H
2O)
42+(aq)+4Cl
-(aq)

CuCl
42-(aq)+4H
2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=
.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)
不变
不变
.
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl
2溶液中有上述转化关系的是(填序号)
abc
abc
.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl
2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.



 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l) CuCl42-(aq)+4H2O(l)的平衡常数为k=
CuCl42-(aq)+4H2O(l)的平衡常数为k=

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案 :和某聚碳酸酯工程塑料(
:和某聚碳酸酯工程塑料( )的原料之一.
)的原料之一.







