
化学与生产、生活密切相关,下列叙述中正确的是
A.用活性炭为榶浆脱色和用双氧水漂白纸浆,其原理相同
B.铜制品在潮湿空气中生锈,其主要原因是发生析氢腐蚀
C.静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体
D.新型能源生物柴油和矿物油主要化学成分相同
科目:高中化学 来源:2016-2017学年天津市宝坻区高二11月联考化学试卷(解析版) 题型:选择题
四个试管中都装有5mL0.1mol/LNa2SO3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水,最先出现浑浊的是
A.20℃,4 mL硫酸,6 mL水 B.20℃,5 mL硫酸,5 mL水
C.30℃,5 mL硫酸,5 mL水 D.30℃,4 mL硫酸,6 mL水
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市钦州港区高三12月月考化学试卷(解析版) 题型:实验题
KMnO4和MnO2都是重要化学物质,在实验室可以做氧化剂和催化剂,某学习小组对两种物质的制备和性质探究如下:
I.MnO2的制备:
该学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其工艺流程如下:
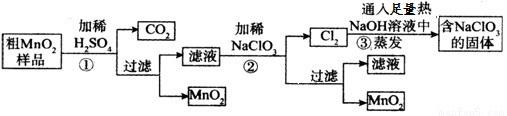
请回答下列问题:
(1)第②步操作中,NaClO3氧化MnSO4的离子方程式为_____________________。
(2)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤。洗涤沉淀所用的玻璃仪器除玻璃棒外,还需要有:_________________,判断是否洗涤干净可选用的试剂是_____________(填化学式)。
(3)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程的阳极反应式为____________。
II.KMnO4的性质与应用:该小组同学利用KMnO4溶液测定某物质的组成:
CuSO4溶液与K2C2O4溶液混合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:I2+2S2O32-=2I+S4O62-
(4)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(5)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为__________________________。若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(6)若用淀粉溶液做指示剂,则滴定终点观察到的现象为__________________。
(7)样品晶体的组成化学式为:_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省钦州市高新区高三12月月考化学试卷(解析版) 题型:选择题
化学与生产、生活、科技等密切相关,下列说法正确的是
A.石油裂解的目的是提高汽油等轻质油的产量和质量
B.“神州七号”的防护层中含聚四氟乙烯,制备聚四氟乙烯的单体属于不饱和烃
C.浓硫酸可用于干燥 SO2、C2H4、O2等气体
SO2、C2H4、O2等气体
D.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上学期期中化学试卷(解析版) 题型:选择题
下列实验操作不能达到预期目的的是
选项 | 实验目的 | 操作 |
A | 证明CH2=CHCHO中含有碳碳双键 | 滴入溴的四氯化碳溶液 |
B | 除去苯中混有的苯酚 | 向混合液中加入过量NaOH溶液,然后分液 |
C | 证明久置的Na2O2没有变质 | 滴加过量稀盐酸,产生无色无 |
D | 比较盐酸与醋酸的酸性强弱 | 分别测定同温同浓度NaCl溶液与CH3COONa溶液的pH |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上月考五化学卷(解析版) 题型:选择题
下列坐标图均涉及平衡原理,其中相关表述正确的是

A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
B.图②表示2SO2(g)+O2(g)  2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
C.图③表示反应2NH3(g)  3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D.图④表示AgCl(s)  Ag+(
Ag+( aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:实验题
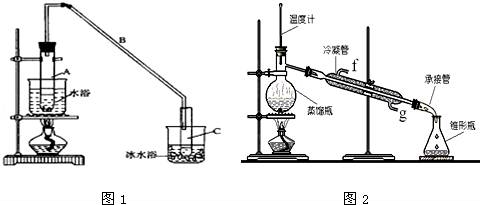
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
已知: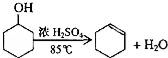
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12. 5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后用 (填入编号)洗涤.
a.KMnO4溶液  b.稀H2SO4 c.Na2CO3溶液
b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从 口进入,目的是
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是
a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 .
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源:2016-2017黑龙江牡丹江第一高级中学高二上期末化学卷(解析版) 题型:选择题
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆 反应方向移动
反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列有关说法正确的是
A.当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C.常温下2S2O(g) 3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D.氯水通入SO2后溶液的酸性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com