
 或NH2-NH-NH-NH-NH-NH2.
或NH2-NH-NH-NH-NH-NH2.分析 (1)根据氮原子和氢原子个数之间的关系确定氢化物的通式;
(2)一氯代物有三种结构说明有机物中含有三种类型的氢原子;
(3)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-两步电离.
解答 解:(1)根据氮原子和氢原子个数之间的关系:氢原子个数比氮原子个数多2,所以通式表示为:NnHn+2(n≥2),
故答案为:NnHn+22(n≥2);
(2)有机物中含有三种类型的氢原子,其一氯代物就有三种结构,为 、NH2-NH-NH-NH-NH-NH2,
、NH2-NH-NH-NH-NH-NH2,
故答案为: 或NH2-NH-NH-NH-NH-NH2;
或NH2-NH-NH-NH-NH-NH2;
(3)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-,
故答案为:N2H5++H2O?N2H62++OH-.
点评 本题涉及通式、结构简式、弱电解质的电离等综合知识的考查,注意知识的归纳和整理是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 物质名称 | 相互关系 | 物质名称 | 相互关系 |
| ①氯仿与三氯甲烷 | ④氕、氘、氚 | ||
| ②一氯甲烷与四氯化碳 | ⑤白磷与红磷 | ||
| ③乙烷与新戊烷 | ⑥正丁烷与异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
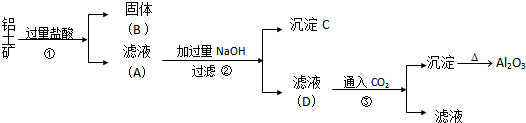
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L二氯甲烷( CH2Cl2)所含的分子数为0.5NA | |
| B. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| C. | 1mol羟基(-OH)所含的电子总数为10NA | |
| D. | 10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,溶液的pH降低 | |
| B. | c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | c(Na+)+c(H+)=2 c(CO32-)+2c(HCO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{12}^{24}$Mg和${\;}_{12}^{26}$Mg互为同位素 | B. | 氯原子的结构示意图 | ||
| C. | 氯化钠的电子式是 | D. | 乙酸与乙醇互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+和SO42- | B. | K+和SO42- | C. | Cu2+和Cl- | D. | Ag+和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com