
【题目】为了使Na2S溶液中![]() 的比值变小,可采取的措施是( )
的比值变小,可采取的措施是( )
①加适量盐酸
②加适量NaOH(s)
③加适量KOH(s)
④加适量KHS(s)
⑤加水
⑥通H2S(g)
⑦加热.
A.②③④ B.①②⑤⑥⑦ C.②③ D.③④
【答案】D
【解析】
试题分析:硫化钠是强碱弱酸盐,硫离子水解导致该溶液呈碱性,要使![]() 减小,可以采用增大硫离子浓度或减小钠离子浓度来实现,据此分析解答.
减小,可以采用增大硫离子浓度或减小钠离子浓度来实现,据此分析解答.
解:①硫离子水解呈碱性,加适量盐酸,促进水解,导致硫离子浓度降低,![]() 增大,故错误;
增大,故错误;
②加适量NaOH(s),钠离子浓度增大且抑制硫离子水解,且钠离子增大程度远远大于抑制硫离子水解程度,所以![]() 增大,故错误;
增大,故错误;
③加适量KOH(s),钠离子浓度不变,但抑制硫离子水解,所以硫离子浓度增大,则![]() 减小,故正确;
减小,故正确;
④加适量KHS(s),钠离子浓度不变,硫氢根离子抑制硫离子水解,所以硫离子浓度增大,![]() 减小,故正确;
减小,故正确;
⑤加水,促进硫离子水解,钠离子物质的量不变、硫离子物质的量减小,所以![]() 增大,故错误;
增大,故错误;
⑥通H2S(g),硫离子和硫化氢反应生成硫氢根离子,所以硫离子浓度降低,![]() 增大,故错误;
增大,故错误;
⑦加热促进硫离子水解,硫离子浓度降低,所以![]() 增大,故错误;
增大,故错误;
故选D.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol·L-1、体积为V0的HA酸溶液和MOH碱溶液,分别加蒸馏水稀释,溶液pH随滴入的蒸馏水体积的变化曲线如图所示,下列叙述正确的是( )
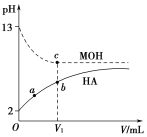
A. HA为强酸,MOH为强碱
B. a点HA的电离度小于10%
C. 两种溶液无限稀释时,其c(H+)近似相等
D. 两种溶液稀释至V1时,b、c两点所示溶液中c(A-)>c(M+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 == K2O+5X+16N2↑,下列说法不正确的是
A. X的化学式为Na2O
B. 每生成1.6molN2,则转移的电子为3 mol
C. 若被氧化的N原子的物质的量为3mol,则氧化产物比还原产物多1.4 mol
D. 上述反应中NaN3被氧化,KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___________________mol·L-1。
(2)下列微粒:①S ②SO32- ③Fe2+ ④Al3+ ⑤Na ⑥HCl ⑦Na2O2在化学反应中只能被氧化的是________(填序号),只能表现出氧化性的是______(填序号)。
(3)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________mol;
(4)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(5)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
____Al+____NO3-+____□ ——____AlO2-______N2↑+____H2O,_____________
(6)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下表格是硫酸试剂标签上的部分内容。请回答下列问题:
硫酸 化学纯(CP)(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g/cm3
质量分数:98%
(1)该浓硫酸中溶质、溶剂分子数目之比为______,现用该浓H2SO4来配制480 mL、0.3 mol·L-1的稀H2SO4,需量取该浓H2SO4的体积为______mL。
(2)配制时,下列仪器中必须使用 ______(填代号), 还缺少的仪器是______、______。
①托盘天平(带砝码) ②10 mL量筒 ③20 mL量筒 ④烧杯
⑤玻璃棒 ⑥100 mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有____________(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是
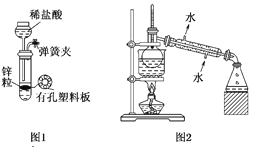
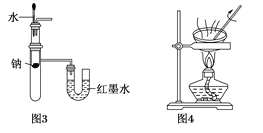
A. 用图1所示装置制取少量纯净的H2
B. 用图2所示装置分离K2CO3溶液和苯的混合物
C. 用图3所示装置验证Na和水反应的热效应
D. 用图4所示装置分离蒸干AlCl3 溶液制取无水AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol﹣1表示。请认真观察下图,然后回答问题.
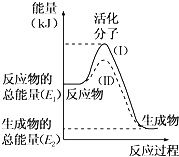
(1)图中所示反应是______(填“吸热”或“放热”)反应。
(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol碘反应生成HI会______(填“放出”或“吸收”)______ kJ的热量.在化学反应过程中,是将______ 转化为______。
(3)下列反应中,属于放热反应的是______,属于吸热反应的是______。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳⑤Ba(OH)28H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A.只由非金属元素组成的化合物中,一定是共价化合物
B.某固体中,存在金属元素,则该物质一定是离子化合物
C.具有离子键的化合物,是离子化合物
D.具有共价键的化合物,是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com