
 现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).
现有FeCl3、FeCl2、CuCl2的混合溶液1L,将0.70mol的铁粉慢慢加入混合液中并充分搅拌,溶液中的三种金属阳离子的物质的量随铁粉加入量的变化曲线如图所示,D点坐标是(0.4,0),H点坐标是(0.7,0.2).| n |
| V |
| n |
| V |
| 0.8mol |
| 1L |
| 0.5mol |
| 1L |
| 1.2mol |
| 1L |
| 0.2mol |
| 1L |


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
| B、实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变升高温度,平衡时氢气转化率增大 |
| D、吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
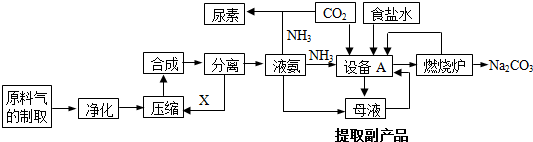

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.
现需配制0.1mol/LNaOH溶液480mL,如图是某同学转移溶液的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com