
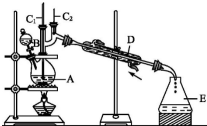
 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,若加热后发现未加沸石,应该冷却后补加;
(3)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗上有活塞,有活塞的仪器一般要检验是否漏液;
(5)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
解答 解:(1)不能将Na2Cr2O7溶液加到浓硫酸中,应该将浓硫酸加到Na2Cr2O7溶液,因为浓硫酸溶于水会放出大量热,容易溅出伤人,
故答案为:不能,浓硫酸溶于水会放出大量热,容易溅出伤人;
(2)沸石的作用是防止液体暴沸,若加热后发现未加沸石,应采取的正确方法是冷却后补加,以避免加热时继续反应而降低产率,
故答案为:防止液体暴沸;冷却后补加;
(3)B仪器是分液漏斗,D仪器是 直形冷凝管,故答案为:分液漏斗; 直形冷凝管;
(4)分液漏斗使用前必须检查是否漏水,应选C,故答案为:C;
(5)因为正丁醛的密度是0.801 7g•cm-3,比水轻,水层在下层,故答案为:下;
(6)反应温度应保持在90~95℃,根据正丁醛的沸点和还原性,主要是为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化,
故答案为:为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.


科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.蒸馏、萃取、分液 D.分液、蒸馏、萃取
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
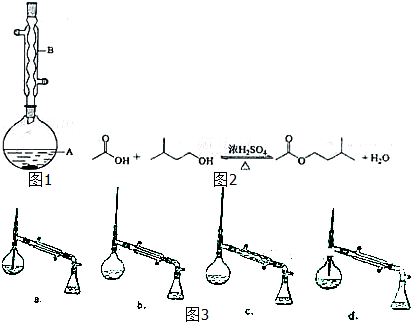
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用如图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
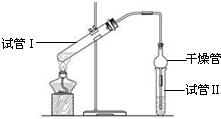
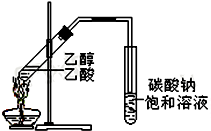 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
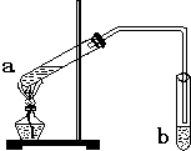 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com