
【题目】研究CO2、CO是处理方法对环境保护用重要意义。
(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=__________。
CH4(g)+2H2O(g) △H=__________。
(2)CO2与H2反应可合成甲醇:CO2(g)+3H2(g)![]() CH4(g)+H2O(g)
CH4(g)+H2O(g)
某温度下,将1molCO2和3molH2充入探究不变的2L密闭容器中,发生上述反应。测得不同时刻的反应前后压强关系如下:
时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
P后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
①用CO2表示第1小时反应的平均速率v(CO2)=_______mol·L-1·h-1。
②该温度下的H2平衡转化率为______________。
(3)CO2与NH3反应可合成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
在T1℃时,将1molCO2和2molNH3置于1L密闭容器中,发生上述反应,在t时刻,测得容器中CO2转化率约为73%。保护其他初始实验条件不变,分别在温度为T2℃、T3℃、T4℃、T5℃时,重复上述实验,经过相同时间测得CO2转化率并绘制变化曲线如图所示:

①该反应的△H______0(填“>”或“<”)
②T4℃时该反应的平衡常数K=___________。
③在T1℃~T3℃之间,CO2转化率逐渐增大,其原因是____________________。
(4)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示
img src="http://thumb.zyjl.cn/questionBank/Upload/2018/01/02/09/ce4caee6/SYS201801020935301407189654_ST/SYS201801020935301407189654_ST.003.png" width="212" height="154" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />
①阳极区产生CO2的原因是______________(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因_____________。
【答案】 -162kJ·mol-1 0.1 40% < 12(mol·L-1)-2 在T1℃~T3℃之间反应未达到平衡状态,且v(正)>v(逆),温度越高,CO2转化率越大(合理即可) H++HCO3-=H2O+CO2↑ HCO3-存在电离平衡:HCO3-![]() H++CO32-,阴极H+放电浓度减小平衡右移, CO32-再生;或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32- ,CO32-再生。(合理即可)
H++CO32-,阴极H+放电浓度减小平衡右移, CO32-再生;或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32- ,CO32-再生。(合理即可)
【解析】(1)已知:①CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
②C(g)+2H2(g)![]() CH4(g) △H=-73kJ·mol-1
CH4(g) △H=-73kJ·mol-1
③2CO(g)![]() C(g)+CO2(g) △H=-171kJ·mol-1
C(g)+CO2(g) △H=-171kJ·mol-1
根据盖斯定律①×2+②+③即得到CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=-162kJ·mol-1。
CH4(g)+2H2O(g) △H=-162kJ·mol-1。
(2) CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
转化量(mol) x 3x x x
平衡量(mol) 1-x 3-3x x x
①1h后有![]() ,解得x=0.2,所以用CO2表示第1小时反应的平均速率v(CO2)=
,解得x=0.2,所以用CO2表示第1小时反应的平均速率v(CO2)=![]() =0.1mol·L-1·h-1。②平衡时有
=0.1mol·L-1·h-1。②平衡时有![]() ,解得x=0.4,所以该温度下的H2平衡转化率为3x/3×100%=40%。
,解得x=0.4,所以该温度下的H2平衡转化率为3x/3×100%=40%。
(3)①转化率达到最大值后升高温度转化率降低,这说明正反应是放热反应,即该反应的△H<0;②T4℃时CO2转化率是0.75,则
2NH3(g) +CO2(g) ![]() CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
起始量(mol) 2 1 0 0
变化量(mol)0.75×2 0.75 0.75 0.75
平衡量(mol)0.5 0.25 0.75 0.75
平衡常数K=![]()
③由于在T1℃~T3℃之间反应未达到平衡状态,且v(正)>v(逆),温度越高,CO2转化率越大
(4)①阳极区氢氧根放电,产生氢离子,氢离子和碳酸氢根反应生成CO2,方程式为H++HCO3-=H2O+CO2↑。②溶液中HCO3-存在电离平衡:HCO3-![]() H+CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生。
H+CO32-,阴极H+放电浓度减小平衡右移,CO32-再生;或阴极H+放电OH-浓度增大,OH-与HCO3-反应生成CO32-,CO32-再生。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列过程中发生了取代反应的是( )
A. 苯加入溴水中,振荡并静置后下层液体变为无色
B. 在催化剂作用下乙烯生成聚乙烯
C. 在铜催化、加热条件下,乙醇与氧气反应
D. 乙醇和乙酸在浓硫酸作用下加热生成乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为周期表的一部分,据此回答下列有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出元素符号:①_______,⑤________,⑦_______,⑧________。
(2)表中所列元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是_______。
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是_________(填化学式,下同),碱性最强的是_________,呈两性的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
B. 向醋酸溶液中加水,醋酸的电离程度增大,  增大
增大
C. 向氨水中滴加盐酸时,离子浓度大小可能是:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
D. 若NaHA溶液中的pH=7,则H2A是弱酸;若NaHA溶液中的pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以跟金属钠反应生成碳链较长的烃,如:CH3Cl + 2Na + CH3Cl → CH3—CH3 + 2NaCl,现有CH3CH2Br和CH3—CHBr—CH3的混合物与金属钠反应后,不可能得到的烃是 ( )
A.2—甲基丁烷 B.2—甲基戊烷 C.2,3—二甲基丁烷 D.丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值 ,下列说法正确的是( )
A. 标准状况下,11.2 LNH3和11.2 LHCl混合后分子总数为NA
B. 7.8gNa2O2含有的阴、阳离子的数目为0.4NA
C. 1 L 0.1mol/L醋酸溶液中含有的氢离子数为0.1NA
D. 标准状况下,2.24LC12与足量铁粉完全反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列说法错误的是
A. 补铁剂与维生素C共同服用可提高补铁效果
B. 铁粉和碳粉的混合物可作食品抗氧化剂
C. 生活中钢铁制品生锈主要是析氢腐蚀所致
D. 新能源汽车的推广使用有助于减少光化学烟雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁子香酚可用于配制康乃馨型香精及制作杀虫剂和防腐剂,结构简式如图。

(1)丁子香酚分子式为______________。
(2)下列物质在一定条件下能跟丁子香酚反应的是___________。
a.NaOH溶液 b.NaHCO3溶液 c.FeCl3溶液 d.Br2的CCl4溶液
(3)符合下述条件的丁子香酚的同分异构体共有____________种,写出其中任意任一种结构简式___________。
①与NaHCO3溶液反应
②苯环上只有两个取代基
③苯环上的一氯取代物只有两种
(4)丁子香酚的某种同分异构体A可发生如下转化(部分反应条件已略去)。
提示:RCH=CHR′![]() RCHO+R′CHO
RCHO+R′CHO
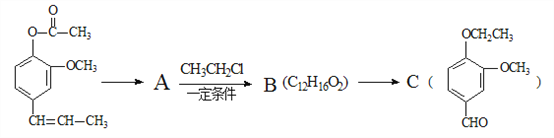
A→B的化学方程式为_______________________,C中滴加少量溴水振荡,主要现象为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com