
| n |
| V |
| 200g×14% |
| 56g/mol |
| n |
| V |
| 0.5mol |
| 0.08L |


科目:高中化学 来源: 题型:
| A、冰醋酸是弱电解质,液态时能导电 |
| B、强电解质溶液的导电能力不一定比弱电解质强 |
| C、盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 |
| D、电解质达到电离平衡后,各种离子的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.
已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42-、NO3- |
| B、碳酸氢钠溶液中离子浓度的大小关系c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) |
| C、碳酸钠溶液中离子浓度的关系2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、向Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时用食醋和酒烧菜,菜味更香 |
| B、蔗糖溶液中加入银氨溶液水浴加热,有银镜生成 |
| C、苯中碳碳键是介于C-C和C=C之间的一种特殊共价键 |
| D、反应2CrO3+3CH3CH2OH+3H2SO4═Cr2(SO4)3+3CH3CHO+6H2O可用于检验是否酒后驾驶,该反应中CrO3作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用食醋可除去热水壶内壁的水垢 |
| B、合成纤维和光导纤维都是新型无机非金属材料 |
| C、酒精能使蛋白质变性,可用于杀菌消毒 |
| D、白酒用于增稠增香的塑化剂邻苯二甲酸二丁酯不溶于水,有毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
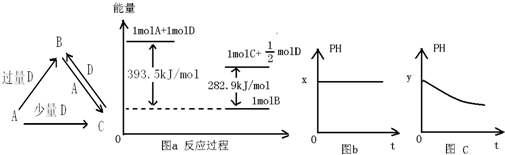
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com