

科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法中错误的是
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引键合电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
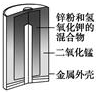 | 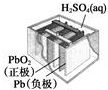 |  | 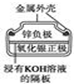 |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示装置中,MnO2是正极,工作时其还原产物是MnOOH | |
| B. | 图Ⅱ所示装置充电过程中,阴极的电极反应式为PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| C. | 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+ 浓度始终不变 | |
| D. | 图Ⅳ所示电池中,工作时OH-移向锌电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋中c(H+)=0.01 moL/L | ||
| C. | 蛋壳浸泡在白醋中有气体放出 | D. | 白醋加入豆浆中有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是由26个原子构成的物质 | B. | 氮元素的质量分数为17.3% | ||
| C. | C、H、O 元素的质量比为10:14:2 | D. | 相对分子质量是162g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
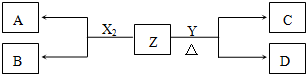
 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com