
【题目】近年来,磁性材料的研究备受国际磁学界的关注。Fe3O4具有许多优异的性能,在磁性材料等领域应用广泛。回答下列问题:
(1)水热法制备Fe3O=纳米颗粒的总反应为3Fe2++2S2O32-+O2+4OHˉ=Fe3O4+S4O62-+2H2O,下列说法正确的是_________(填字母)
A.S2O32-是氧化剂
B.被氧化的Fe2+和未被氧化的Fe2+个数之比为1:2
C.每生成1 mol Fe 3O4,则转移电子数为2mol
D.该反应中氧化剂与还原剂的物质的量之比为1:4
(2)已知:H2O(1)=H2(g)+1/2O2(g) △H1=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:过程I的热化学方程式为2Fe3O4(s) ![]() 6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。
6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,则过程II的热化学方程式为____________。

(3)化学共沉淀法是制备Fe3O4颗粒最常用的方法之一,方法是将FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,则该反应的离子方程式为______________________,由下表数据可知,Fe2+和Fe3+的最佳投料比为1:1.85,原因可能是_____________________。
表 不同投料比得到Fe3O4的结果

(4)磁铁矿(Fe3O4)是工业上冶炼铁的原料之一,发生的主要反应为Fe3O4(s)+4CO![]() 3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2,该反应的△H<0,T℃时,在1L恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①CO的平衡转化率是______________,T℃时,该反应的平衡常数K=__________。
②欲提高该反应中CO的平衡转化率,可采取的措施是_____________(任写一个即可)。
③其他条件不变时,该反应在不同温度下,CO2含量随时间的变化![]() (CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。
(CO2)~t曲线如图所示,温度T1、T2、T3由大到小的关系是___________,判断依据是____________。

【答案】 D 3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ/mol Fe2++2Fe3++8OH-=Fe3O4+4H2O Fe2+容易被氧化为Fe3+ 80% 256 移出CO2或降低温变 T1>T2>T3 其他条件相同时,图像斜率: T1>T2>T3,即反应速率: T1>T2>T3,而温度越高,反应速率越快,所以T1>T2>T3
【解析】(1)A.反应中Fe2+→Fe3O4,Fe元素化合价升高,S2O32-→S4O62-,S元素的化合价升高,Fe2+和S2O32-都是还原剂,选项A错误;B. 3molFe2+参与反应时生成1mol Fe3O4,2molFe2+被氧化,则被氧化的Fe2+和未被氧化的Fe2+个数之比为2:1,选项错误;C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,选项C错误;D.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中氧化剂O2与还原剂Fe2+和S2O32-的物质的量之比为1:4,选项D正确。答案选D;(2)根据图中信息可知,过程II的方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s),已知①H2O(1)=H2(g)+1/2O2(g) △H1=+285.5kJ·mol-1,②2Fe3O4(s) ![]() 6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,根据盖斯定律,由①-②×
6FeO(s)+O2(g) △H2=+313.2kJ·mol-1,根据盖斯定律,由①-②×![]() 得反应3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+285.5kJ·mol-1-313.2kJ·mol-1×
得反应3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+285.5kJ·mol-1-313.2kJ·mol-1×![]() =+128.9kJ/mol;(3)FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,反应的离子方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O,由下表数据可知,Fe2+容易被氧化为Fe3+,为保证Fe2+足够,Fe2+和Fe3+的最佳投料比为1:1.85;(4)①1L恒容密闭容器中,CO 0.5mol mol 即0.5 mol /L,达到平衡时,容器中CO2的浓度是0.4 mol /L,所以平衡时CO的浓度是0.1 mol /L,CO的平衡转化率是
=+128.9kJ/mol;(3)FeSO4和FeCl3溶液以1:2投料比混合,再加入NaOH溶液,即可产生Fe3O4颗粒,反应的离子方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O,由下表数据可知,Fe2+容易被氧化为Fe3+,为保证Fe2+足够,Fe2+和Fe3+的最佳投料比为1:1.85;(4)①1L恒容密闭容器中,CO 0.5mol mol 即0.5 mol /L,达到平衡时,容器中CO2的浓度是0.4 mol /L,所以平衡时CO的浓度是0.1 mol /L,CO的平衡转化率是![]() =80%;该反应的平衡常数K=
=80%;该反应的平衡常数K=![]() =256;②欲提高该反应中CO的平衡转化率,则使平衡正向移动,可采取的措施是移出CO2或降低温变;③温度T1、T2、T3由大到小的关系是T1>T2>T3,判断依据是其他条件相同时,图像斜率: T1>T2>T3,即反应速率: T1>T2>T3,而温度越高,反应速率越快,所以T1>T2>T3。
=256;②欲提高该反应中CO的平衡转化率,则使平衡正向移动,可采取的措施是移出CO2或降低温变;③温度T1、T2、T3由大到小的关系是T1>T2>T3,判断依据是其他条件相同时,图像斜率: T1>T2>T3,即反应速率: T1>T2>T3,而温度越高,反应速率越快,所以T1>T2>T3。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:

下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极附近溶液的碱性不变
B.充电过程是化学能转化为电能的过程
C.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
A.该反应正反应为吸热反应
B.达平衡时,甲、乙容器内:2c(CO2 , 甲)<c(CO2 , 乙)
C.达平衡时,容器甲中的逆反应速率比容器乙中的大
D.达平衡时,转化率:a(CO2 , 甲)+a(C2H5OH,丙)>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2,工艺流程如下:
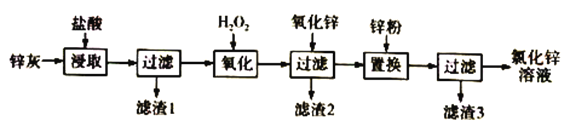
回答下列问题
(1)“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是________________、____________________。

(2)“滤渣1”的主要成分是_____________。
(3)H2O2溶液的作用是____________________________________,已知“滤渣2”的主要成分是Fe(OH)3,则氧化锌的作用是_______________________________。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、___________________________________。
(4)由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2-,则阴极的电极反应为___________________________________。
(5)ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z,为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,2 L密闭容器内,反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO))/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
该反应达到平衡状态的时间是
A.3 min
B.1 min
C.2 min
D.0 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种新型锂电池装置,电池充、放电反应为xLi+LiV3O8![]() Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是
Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极反应为xLi++xe-+LiV3O8=Li1+xV3O8
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B是生活中常見的有机物, E的产量是石油化工发展水平的标志.根据下面转化关系回答下列问题:
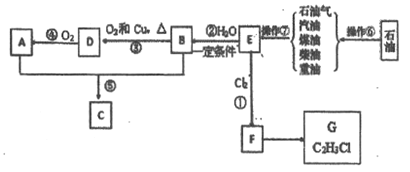
(1)在①~⑤中原子利用率为100%的反应是_____(填序号)。
(2)操作⑥、操作⑦的名称分別为_____、______。
(3)写出反应③的化学方程式________。
(4)写出反应⑤的化学方程式_________。
(5)G可以发生聚合反应生产塑料,其化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下N2和O2发生反应N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
(1)下图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g)![]() 2NO(g)为_______(填“吸热”或“放热”)反应。
2NO(g)为_______(填“吸热”或“放热”)反应。

(2)2000℃时向容积为2L的密闭容器中充入10molN2与5molO2,达到平衡后NO的物质的量为2mol,则此反应的平衡常数K=____。该温度下,若开始时向上述容器中充入N2和O2均为1mol,则达到平衡后N2的转化率为______。
(3)汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:__________。
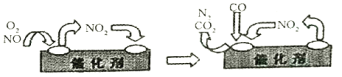
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氢氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4还原NO2至N2共放出热量867kJ,则△H2=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com