
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 标况下O2的体积取决于O2分子间的距离 | |
| C. | 常温常压下4.9LO3含有的O约为9.6g | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |
分析 A.摩尔是物质的量的单位,不是物理量;
B.标况下O2的体积取决于O2分子数目;
C.常温常压下,气体摩尔体积大于22.4L/mol;
D.气体摩尔体积与温度和压强有关,气体摩尔体积为22.4L•mol-1,未必所处条件为标准状况.
解答 解:A.物质的量是表示微粒数目集合体的物理量,其单位是摩尔,摩尔是物质的量的单位,不是物理量,故A错误;
B.标况下O2的体积取决于O2分子数目,标况下距离是定值,故B错误;
C.常温常压下,气体摩尔体积大于22.4L/mol,所以O3的物质的量小于0.21875,所以质量小于10.5g,含有的O约为9.6g,故C正确;
D.气体摩尔体积是单位物质的量的气体所占有的体积,气体体积与温度和压强有关,温度升高,气体体积增大,压强增大,气体体积减小,所以不是在标况下,气体摩尔体积有可能为22.4 L•mol-1,故D错误;
故选C.
点评 本题主要考查的是摩尔的定义以及气体摩尔体积的定义,属于概念性理解题,注意影响气体体积的因素有物质的量、温度和压强,注意总结,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的分子数为3NA | |
| C. | 标准状况下,11.2LCl2含有的分子数小于0.5NA | |
| D. | 在常温常压下,11.2LCCL4含有的分子数小于0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在吸热反应中,反应物的总能量高于生成物的总能量 | |
| D. | 需要加热的化学反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
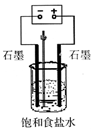 (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下含有NA个NO2、N2O4分子的混合气体,降温至标准状况,其体积小于22.4 L | |
| B. | 相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 | |
| C. | 标准状况下,44.8 L NO与22.4 L O2充分反应后得到的气体分子数小于2NA | |
| D. | 在常温常压下,2.24 L SO2与O2的混合气体中所含氧原子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com