
【题目】(1)标准状况下:①0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④0.2molCH4。体积最大的是___;密度最大的是___;质量最大的是___。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为___,氧元素的质量之比为___,原子总数之比为___。
【答案】① ② ③ 5:4 5:6 15:16
【解析】
(1)①0.3mol氨气,质量为0.3mol×17g/mol=5.1g,
②6.02×1022个CO2分子,物质的量为![]() =0.1mol,质量为0.1mol×44g/mol=4.4g,
=0.1mol,质量为0.1mol×44g/mol=4.4g,
③7.3gHCl,其物质的量为![]() =0.2mol,
=0.2mol,
④0.2molCH4,质量为0.2mol×16g/mol=3.2g,
相同条件下,体积之比等于物质的量之比,故体积最大的是:①0.3mol氨气,
相同条件下,密度之比等于相对分子质量之比,CO2的相对分子质量最大,故密度最大的是:②CO2分子,由上述计算可知,质量最大的是:③7.3gHCl,
故答案为:①;②;③;
(2)根据n=![]() 可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,
可知,物质的量之比与摩尔质量成反比,故相同质量的SO2与SO3的物质的量之比为80g/mol:64g/mol=5:4,
相同质量SO2与SO3分子中含有的氧元素的质量之比为(5×2):(4×3)=5:6,
相同质量SO2与SO3分子中含有原子数目之比为(5×3):(4×4)=15:16;
故答案为:5:4;5:6;15:16。


 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
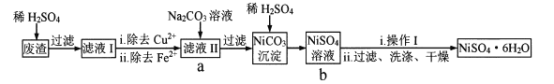
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物K是一种聚酯材料,合成路线如下:

己知:①AlCl3为生成A的有机反应的催化剂
②F不能与银氨溶液发生反应,但能与Na反应。
(1)生成A的有机反应类型为________。生成A的有机反应分为以下三步:
第一步:CH3COCl+AlCl3→CH3CO++AlCl4,
第二步:____________________
第三步:AlCl4-+H+→AlCl3+HCl
请写出第二步反应。
(2)B的化学名称为反应条件①为______________,反应条件②为_______________。
(3)由乙炔生成F的化学方程式为____________________。
(4)F的同分异构体很多,其中能同时满足这以下4个条件的链状化合物共有_________种(包括顺反异构和对映异构);
①含有三种官能团;②能与新制的Cu(OH)2悬浊液反应;③氧原子不与碳碳双键相连
④与Na反应可放出氢气
(5)K的结构简式为_________________。
(6)请以乙炔和丙酮为原料,按照加成、加成、消去的反应类型顺序三步合成天然橡胶的单体。(无机试剂任选)________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定条件下,恒压容器中发生反应:2X(g)+Y(g)![]() 2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
A. 单位时间内生成2n mol X,同时生成nmol Y
B. 混合体系的密度不再变化,说明该反应达到化学平衡状态
C. 反应过程中,X和Z的物质的量之和保持不变
D. 向容器中加入0.2 mol X与0.1 molY充分反应,放出热量为0.lakJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物(![]() )的结构、性质有关的叙述正确的是
)的结构、性质有关的叙述正确的是
A. 该物质所有原子可能在同一平面
B. 与该物质具有相同官能团的芳香烃同分异构体有2种
C. 该物质在一定条件下能发生加成反应、氧化反应、取代反应、加聚反应
D. 1mol该物质最多可与1moBr2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是( )

A.浓硫酸B.NaOH溶液C.水D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 1mol乙酸乙酯在稀硫酸中水解生成的乙醇分子中含共价键数目为8NA
B. 18.0g葡萄糖和果糖的混合物中含羟基数目为0.5NA
C. 1L0.5mol·L-1 CuSO4溶液清除P4完全反应生成Cu、H2SO4和H3PO4时转移电子数为2.5NA
D. 标准状况下,2.24LD2和H2的混合气体中含中子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如表提供的数据可知,在溶液中能大量共存的微粒组是

A. H2CO3 、HCO3-、CH3COO-、CN-
B. CO32-、 HCO3-、CH3COOH、CN-
C. HCO3-、CH3COO-、CN-、HCN
D. HCN 、HCO3-、CN-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com