
| A. | 0.1mol/L的NaHSO3溶液中:c(OH-)-c(H+)=c(SO32-)-c(H2SO3) | |
| B. | 1L 0.1mol/L的(NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性时:c(SO42-)>c(Na+)=c(NH4+)>c(OH-)=c(H+) |
分析 A.根据亚硫酸氢钠溶液中的物料守恒和电荷守恒判断;
B.水解程度较小,则c(NH4+)>c(Fe2+),硫酸根离子不水解,则其浓度最大,水解后溶液显示酸性,则c(H+)>c(OH-);
C.氢氧化钠为强碱溶液,其浓度最小,碳酸钠的水解程度大于醋酸钠,则碳酸钠溶液浓度小于醋酸钠;
D.当硫酸氢铵与氢氧化钠的物质的量相等时,反应生成硫酸铵、硫酸钠,溶液显示酸性,所以加入的氢氧化钠应该稍过量,则c(Na+)>c(SO42-).
解答 解:A.0.1mol/L的NaHSO3溶液中,根据电荷守恒可得:c(OH-)+2c(SO32-)+c(HSO3-)=c(H+)+c(Na+),根据物料守恒可得:c(H2SO3)+c(SO32-)+c(HSO3-)=c(Na+),二者结合可得:c(OH-)-c(H+)=c(H2SO3)-c(SO32-),故A错误;
B.1L 0.1mol•L-1(NH4)2Fe(SO4)2溶液中,铵根离子和亚铁离子部分水解,溶液显示酸性;由于水解程度较小,则铵根离子浓度大于亚铁离子浓度,硫酸根离子不水解,其浓度最大,则得到溶液中离子浓度大小为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故B正确;
C.pH相等的CH3COONa、NaOH和Na2CO3三种溶液,NaOH为强碱溶液,所以氢氧化钠溶液的浓度最小;碳酸钠溶液的水解程度大于醋酸钠,则pH相同时,醋酸钠的浓度大小碳酸钠,所以三种溶液的浓度大小为::c(NaOH)<c(Na2CO3)<c(CH3COONa),故C错误;
D.常温下,向0.01mol/L NH4HSO4溶液中滴加0.01mol/L NaOH溶液至中性,NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3•H2O更难电离),当加入等物质的量的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+),所以正确的离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可由下列路线合成:
)可由下列路线合成: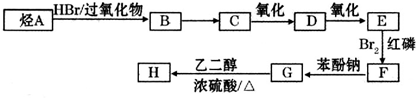
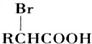
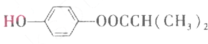 .
.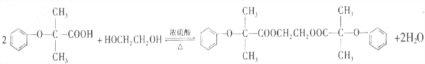 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”危害健康,是因为脂肪酸油脂中的碳碳双键被破坏,不利健康 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土可用作水果保鲜制是因为高锰酸钾溶液可吸收水果释放的乙烯 | |
| C. | 废旧电池必须回收利用,是因为电池中的重金属等会严重污染土壤和水体 | |
| D. | 食品包装袋、食物保鲜膜通常用聚乙烯树脂,是因为聚乙烯树脂是无毒的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 苯滴加到溴水中,振荡后水层接近无色 | |
| C. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 | |
| D. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com