
 .
.分析 (1)共价化合物的熔沸点较低,离子化合物熔沸点较高;
(2)根据ρ=$\frac{M}{{V}_{m}}$计算氯化铝蒸气摩尔质量,从而确定其化学式;
(3)熔融状态下离子化合物导电、共价化合物不导电.
解答 解:(1)由题给数据可知氯化铝的熔沸点较低,不可能是离子化合物,只能是共价化合物,故答案为:共价化合物;
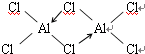
(2)M氯化铝=11.92 g•L-1×22.4 L•mol-1=267 g•mol-1,所以氯化铝的化学式为Al2Cl6,结构式为 ,
,
故答案为:Al2Cl6; ;
;
(3)离子化合物是由阴阳离子构成的,共价化合物是由分子构成的,共价化合物和离子化合物的典型区别就是熔融状态下离子化合物能导电,而共价化合物不导电,
答:在一定条件下,将AlCl3晶体加热至融化,然后做导电性实验,若不导电,则为共价化合物.
点评 本题考查了离子化合物和共价化合物的判断及实验方案设计,明确离子化合物和共价化合物的区别是解本题关键,根据其构成微粒分析解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应CO(g)+NO2(g)=CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| B. | 实验室制备氢气,用粗锌代替纯锌,反应速率加快 | |
| C. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
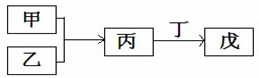 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为:甲<丙<戊 | |
| B. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2 | |
| C. | 若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3s23p8 | B. | 3d10 | C. | 3s23p64s2 | D. | 3s23p63d2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HCl | Cl2 | HClO |
| C | H2SO4 | SO2 | SO3 |
| D | CH2=CH2 | CH3CH2OH | CH3CHO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层有3个电子的一种金属 | |
| B. | 熔点低于100℃的一种金属 | |
| C. | 次外电子层上有8个电子的一种元素 | |
| D. | 除最外层,原子的其他电子层电子数目均达饱和的一种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液与稀硝酸反应:Ca(HCO3)2+2H+=Ca2++CO2↑+H2O | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. |  | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com