
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 除去葡萄糖溶液中的乙醇 | 用KMnO4氧化,再蒸馏 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者都与氢氧化钠溶液反应;
B.二者都与高锰酸钾反应;
C.碘酸钾与淀粉不反应;
D.醋酸可与氢氧化钠发生中和反应.
解答 解:A.乙酸乙酯在碱性条件下水解,不能用氢氧化钠溶液,应用饱和碳酸钠溶液除杂,故A错误;
B.二者都与高锰酸钾反应,不能用高锰酸钾除杂,故B错误;
C.碘酸钾与淀粉不反应,应用淀粉-KI溶液,且滴加醋酸酸化,故C错误;
D.醋酸可与氢氧化钠发生中和反应,反应后呈碱性,可用酚酞为指示剂,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的检验、物质的制备、分离以及指示剂等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
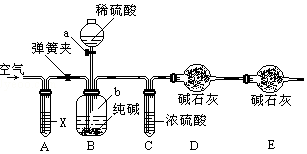 某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:
某纯碱样品中含有少量氯化钠杂质,现用如图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去).实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 142g氯气中含Cl2的分子数为2NA | |
| B. | 1.7gOH-中所含电子的数目为NA | |
| C. | 49g硫酸中所含氧原子的数目为2NA | |
| D. | 71g硫酸钠中所含钠离子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2gCH3OH含有的化学键数为0.4NA | |
| B. | 0.1molFeCl3水解制得的Fe(OH)3胶体中胶粒数是0.1NA | |
| C. | 标准状况下,2.24LCl2溶于足量水,转移的电子数为0.1NA | |
| D. | 0.2gD216O中含有的质子数、中子数和电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用聚氯乙烯代替乙烯制作食品包装袋 | |
| B. | 去除银器表面Ag2S,可将银器放在盛有食醋的铝锅中煮沸片刻 | |
| C. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都符合环保理念 | |
| D. | “连续纤维增韧”航空材料主要是由碳化硅、陶瓷和碳纤维复合而成,是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3粉末与同浓度的盐酸时,Na2CO3因为碱性强,所以与盐酸反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3所消耗盐酸的体积是 NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通人过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com