
| A. | C、N、O元素的单质与氢气化合越来越难 | |
| B. | Li、Na、K的氧化物的水化物的碱性依次减弱 | |
| C. | Na、Mg、Al的简单离子的氧化性以依次增强 | |
| D. | P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱 |
分析 A.非金属性越强,越易与氢气化合;
B.金属性越强,对应碱的碱性越强;
C.金属性越强,对应阳离子的氧化性越弱;
D.非金属性越强,对应氢化物越稳定.
解答 解:A.非金属性越强,越易与氢气化合,则C、N、O元素的单质与氢气化合越来越易,故A错误;
B.金属性越强,对应碱的碱性越强,则Li、Na、K的氧化物的水化物的碱性依次增强,故B错误;
C.金属性越强,对应阳离子的氧化性越弱,则Na、Mg、Al的简单离子的氧化性以依次增强,故C正确;
D.非金属性越强,对应氢化物越稳定,则P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次增强,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
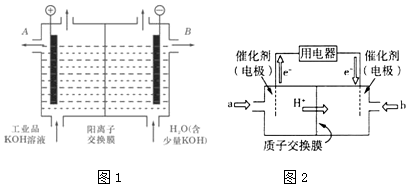
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E |
| ①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为: 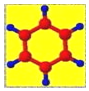 | ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为: 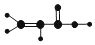 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
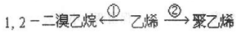
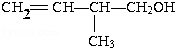
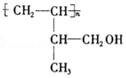 ;
;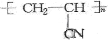 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
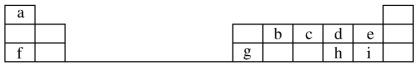
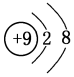 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为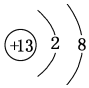 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.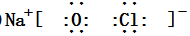 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;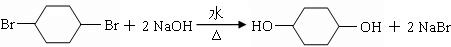 .
.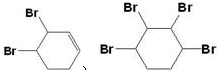 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
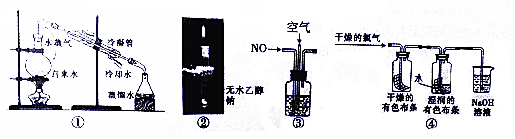
| A. | 图①用于除去自来水中的Fe3+、C1-等杂质离子 | |
| B. | 图②中直接点燃气体,证明钠与乙醇反应的气体产物是H2 | |
| C. | 图③在探究NO充分转化成HNO3的实验中,观察气泡速率控制通入气体体积比 | |
| D. | 图④用该实验可以证明Cl2体现漂白作用的原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法可以除去食盐水中的泥沙 | |
| B. | 酒精灯加热烧瓶时不用垫石棉网 | |
| C. | 氯化氢气体能使干燥的蓝色石蕊试纸变红 | |
| D. | 盛放氢氧化钠溶液的玻璃瓶,可以使用橡胶塞或玻璃塞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com