
下列实验方案可行的是( )
A.检验溶液中是否有SO42-时,加入BaCl2溶液,再加稀硝酸,观察沉淀是否消失
B.将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中,检验气体中是否含有乙烯
C.选用25 mL碱式滴定管量取14.80 mL 1 mol·L-1 NaOH溶液
D.检验溶液中是否含有CO32-时,加入稀盐酸,将产生的气体通入澄清石灰水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
一定条件下,在密闭容器中,能 表示反应X(g)+2Y(g)
表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨所需的氢气可 用煤和水作原料经多步反应制得,其中的一步反应为
用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+H2O(g)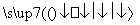 CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是 ( )
A.增加 压强 B.降低温度
压强 B.降低温度
C.增大CO 的浓度 D.更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
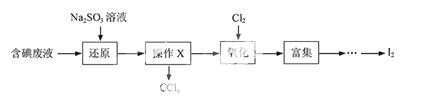
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
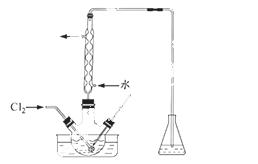
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32—+2IO3—+2H+ I2+5SO42—+H2O
I2+5SO42—+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3—的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可 |
实验流程如下:
C6H12O6溶液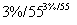


 悬浊液
悬浊液

 Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
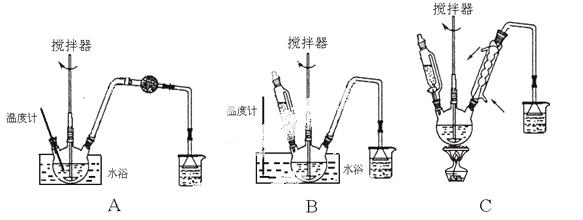
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是________。
制备葡萄糖酸钙 的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是___________________________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝的食品添加剂,逐步转换为无铝的食品添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)和碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数ω(NaHCO3),实验小组同学设计了如下装置进行实验。

实验过程:
①按上图组装仪器,检查装置的气密性;
②将试样m1 g放入硬质玻璃管中,装置B、C、D中药品如上 图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
图,已知加药品后装置B的质量为m2 g、装置C的质量为m3 g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4 g、装置C的质量为m5 g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)装置B的作用为
________________________________________________________________________;
装置C的作用为
________________________________________________________________________。
(3)实验过程中通入N2的目的为
________________________________________________________________________。
(4)用下列各项所提供的数据能计算出ω(NaHCO3)的是________(填选项字母)。
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的ω(NaHCO3),若能,写出ω(NaHCO3)的计算式。
________(填“能”或“不能”),________(若不能,此空不作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积可变的密闭容器中,甲醇在浓硫酸的作用下发生如下反应:
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-25kJ·mol-1
A. 2mol甲醇参加反应,放出的热量为25kJ
B. 浓硫酸在反应中只作催化剂
C. 2υ(CH3OH)=υ(CH3OCH3)
D. 升高温度或增大压强均可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 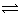 2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W 的体积分数减小,△H 增大
②以 Y 的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加 1 mol X ,则 X 和 Y 的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=13的NaOH溶液与pH=2的H2SO4溶液混合,所得溶液的pH=11,则NaOH溶液与H2SO4溶液的体积比是( ).
A.11∶1 B.9∶1 C.1∶11 D.1∶9.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com