
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是____________
a.反应速率 v( NH3) =v( N2) b.容器内压强不再随时间而发生变化 c.容器内 N2 的物质的量分数不再随时间而发生变化 d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6 e.12molN-H 键断裂的同时生成 5mol N≡N 键 f.混合气体的总质量不随时间的变化而变化
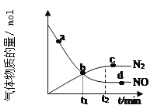
②某次实验中测得容器内 NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆) (填﹥、﹤或﹦)。
(2) 已知:N≡N的键能为946kJ/mol, H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则N2与H2反应,生成1mol NH3过程中______(填“吸收”或“放出”)的能量为_______kJ。
(3) 一定条件下,在 5 L密闭容器内,反应 2NO2(g) ![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用 N2O4 表示 0~2 s 内该反应的平均速率为________ molL-1s-1。在第 5s 时,NO2 的转化率为___________。
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
③为加快反应速率,可以采取的措施是_______
a.升高温度 b.恒容时充入He气 c.恒压时充入He气 d.恒容时充入NO2
【答案】bc > = 放出 46 0.0015 87.5% 随着反应的进行,NO2浓度减小,反应速率减小 ad
【解析】
(1)①可逆反应达到平衡时,同物质的正逆反应速率相等,各组分的浓度,含量保持不变,由此衍生出其他的一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明达到平衡;
②可逆反应正向进行时v正>v逆,平衡时v正=v逆;
(2)焓变=反应物总键能-生成物总键能;
(3)②降低温度、浓度减小等因素可以使反应速率降低;
③升高温度、增大浓度、缩小体积增大压强、加入催化剂可以增大反应速率。
(1)①a.反应速率之比等于计量数之比,该反应达到平衡状态时,5v正(NH3)=4v逆(N2),故a错误;
b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不在改变,反应达到平衡状态,故c正确;
d.物质的量之比等于计量数之比不能说明正逆反应速率相等或者浓度不变,故d错误;
e.12molN-H 键断裂的同时生成5molN≡N键均表示正反应速率,故e错误;
f.反应物和生成物均为气体,所以混合气体的总质量不变为定值,故f错误;
故答案为:bc;
②图中b点未平衡,NO的物质的量还在减少,所以图中b点对应的速率关系是v(正)>v(逆); d点NO的物质的量不再改变,反应达到平衡时ν(正)=ν(逆);
(2)N2与H2反应,生成1mol NH3热化学方程式为![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)△H,该反应△H=
H2(g)NH3(g)△H,该反应△H=![]() ×946kJ/mol+
×946kJ/mol+![]() ×436kJ/mol-3×391kJ/mol=-46 kJ/mol,焓变小于0为放热反应,所以生成1mol NH3的过程中方程46kJ能量;
×436kJ/mol-3×391kJ/mol=-46 kJ/mol,焓变小于0为放热反应,所以生成1mol NH3的过程中方程46kJ能量;
(3)①0~2s内△n(NO2)=0.040mol-0.010mol=0.030mol,根据反应方程式可知该时段内△n(N2O4)=0.015mol,容器体积为5L,所以v(N2O4)=![]() =0.0015 molL-1s-1;第5s时△n(NO2)=0.040mol-0.005mol=0.035mol,所以NO2的转化率为
=0.0015 molL-1s-1;第5s时△n(NO2)=0.040mol-0.005mol=0.035mol,所以NO2的转化率为![]() =87.5%;
=87.5%;
②该反应正反应为放热反应,反应进行温度升高,所以温度对速率的影响是增大,则应考虑浓度对反应速率的影响,随着反应的进行,NO2浓度减小,反应速率减小;
③a.升高温度可以增大活化分子百分数,增大反应速率,故a符合题意;
b.恒容时充入He气,反应物和生成物的浓度不变,不影响反应速率,故b不符合题意;
c.恒压时充入He气,容器体积增大,反应物和生成物浓度减小,反应速率减慢,故c不符合题意;
d.恒容充入NO2,反应物浓度增大,反应速率加快,故d符合题意;
综上所述选ad。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1molNa2O2所含的离子总数是0.4NA
B.0.1mol的11B中,含有0.6NA个中子
C.常温常压下,124gP4中所含P—P键数目为4NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在生产生活中具有广泛的用途。
(1)工业生产粗硅的化学反应方程式为:SiO2+2C![]() Si(粗硅)+2CO↑。该反应中,被还原的元素是___,还原剂是___(填化学式),若转移1mol电子则生成的CO在标准状况下的体积为___L。
Si(粗硅)+2CO↑。该反应中,被还原的元素是___,还原剂是___(填化学式),若转移1mol电子则生成的CO在标准状况下的体积为___L。
(2)由粗硅制纯硅的过程为:
Ⅰ.粗硅与氯气反应生成四氯化硅(SiCl4);
Ⅱ.在高温下用氢气还原四氯化硅得到纯硅。Ⅱ所发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是

A.b电极发生还原反应:4H++O2+4e-=2H2O
B.电路中有4mol电子发生转移,大约消耗标准状况下22.4L空气
C.维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子
D.HS-在硫氧化菌作用下转化为![]() 的反应是
的反应是![]() =
=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H >0
Z(g)+W(s);△H >0
下列叙述正确的是
A. 减少少量W,逆反应速率减小
B. 当容器中气体的平均摩尔质量不变时,反应达到平衡
C. 降低温度,平衡正向移动
D. 平衡后加入Z,上述反应的△H减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
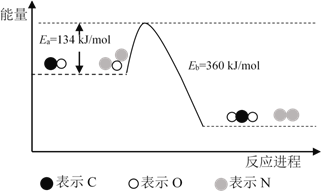
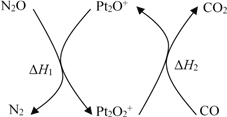
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A.常温常压下,2 g D2O 中含中子数为NA
B.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C.0.5mol羟基中所含电子数为4.5NA
D.28g乙烯和丙烯(C3H6)的混合气体含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pt-g-C3N4光催化氧化法脱除NO的过程如图所示。该脱除过程中,下列说法不正确的是

A.该脱除过程中太阳能转化为化学能。
B.在Pt端发生的是氧化反应
C.过程①发生的反应为H2O2 - 2e-=O2↑+ 2H+
D.过程③的化学方程式2NO2 + H2O2= 2HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2—二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:

回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________;(填正确选项前的字母)
a. 引发反应 b. 加快反应速度
c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钠溶液 d 饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的方法是D装置中____________________________;
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,溶液分层,产物应在______层(填“上”“下”);分离该有机物的方法叫_______________。
(5)若产物中有少量乙醚生成,最好用__________除去;(填正确选项前的字母)
a蒸发 b 蒸馏 c 重结晶
(6)反应过程中应用冷水冷却装置D,其主要目的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com