
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测量溶液的温度计要一直插在溶液中 | |
| B. | 应该向酸(碱)中慢慢滴加碱(酸) | |
| C. | 反应前需要用温度计测量酸(碱)温度 | |
| D. | 反应中酸或碱应适当过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{9a}$ mol-1 | B. | 9a mol-1 | C. | 2a mol-1 | D. | 18a mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸用量偏大,生成CO2气体的量偏大 | |
| B. | 盐酸用量偏大,生成CO2气体的量偏小 | |
| C. | 盐酸用量偏小,生成CO2气体的量偏大 | |
| D. | 盐酸用量偏小,生成CO2气体的量偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14.2g | B. | 7.3g | C. | 3.65g | D. | 7.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.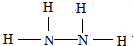 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com