
| m |
| M |
| 24.5g |
| 98g/mol |


科目:高中化学 来源: 题型:
 某有机物的结构简式如图所示.1mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为( )
某有机物的结构简式如图所示.1mol该有机物与足量的NaOH溶液共热,充分反应后最多可消耗NaOH的物质的量为( )| A、2 mol |
| B、4 mol |
| C、6 mol |
| D、8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以用溴水鉴别乙烯和苯 |
| B、可以用金属钠鉴别乙醇和乙酸 |
| C、用无水硫酸铜可以鉴别酒精中是否含有水 |
| D、可以用烧灼的方法鉴别真丝布料和纯棉布料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
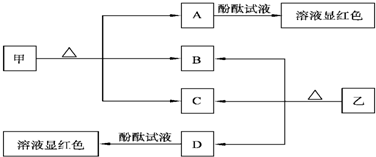
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
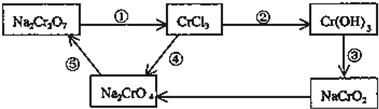
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com