
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO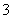 )=
)= 0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后
0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后 ,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
,两极均收集到1.12 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
解析 阳极是阴离子放电(放电能力:OH->NO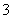 ),根据题给信息,阳极一定是OH-放电,生成0.05 mol氧气,转移0.2 mol电子;阴极离子放电能力:Cu2+>H+>Na+,所以Cu2+先放电,然后是H+放电,阴极生成0.05 mol氢气时,转移0.1 mol电子,根据得失电子守恒知,Cu2+转移0.1 mol电子,n(Cu2+)=0.05 mol。所以原溶液中n[Cu(NO3)2]=0.05 mol,n(NO
),根据题给信息,阳极一定是OH-放电,生成0.05 mol氧气,转移0.2 mol电子;阴极离子放电能力:Cu2+>H+>Na+,所以Cu2+先放电,然后是H+放电,阴极生成0.05 mol氢气时,转移0.1 mol电子,根据得失电子守恒知,Cu2+转移0.1 mol电子,n(Cu2+)=0.05 mol。所以原溶液中n[Cu(NO3)2]=0.05 mol,n(NO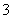 )=0.3 mol/L×0.5 L=0.15 mol,n(NaNO3)=0.05 mol。原混合溶液中c(Na+)=0.1 mol·L-1,A项错误;结合以上分析及电解总方程式Cu2++2H2O
)=0.3 mol/L×0.5 L=0.15 mol,n(NaNO3)=0.05 mol。原混合溶液中c(Na+)=0.1 mol·L-1,A项错误;结合以上分析及电解总方程式Cu2++2H2O Cu+H2↑+O2↑+2H+可知,生成0.05 mol Cu、0.05 mol O2、0.05 mol H2和0.1 mol H+,电解后溶液中c(H+)=
Cu+H2↑+O2↑+2H+可知,生成0.05 mol Cu、0.05 mol O2、0.05 mol H2和0.1 mol H+,电解后溶液中c(H+)=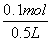 =0.2 mol·L-1,B项正确,D项错误;上述电解过程中共转移0.2 mol电子,C项错误。
=0.2 mol·L-1,B项正确,D项错误;上述电解过程中共转移0.2 mol电子,C项错误。
答案 B


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
容器中发生如下反应:N2+3H2 2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
 ⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b== 。在此情况下,反应起始时将向 方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-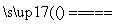 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO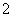 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO
D.用食醋除去水瓶中的水垢:CO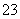 +2CH3COOH===2CH3COO-+CO2↑+H2O
+2CH3COOH===2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+5/2O2(g)―→2CO2(g)+H2O(l)
ΔH=-1 300 kJ/mol
②C6H6(g)+15/2O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ/mol
下列说法正确的是( )
A.1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B.1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C.相同条件下,等质量的C2H2(g)与C 6H6(g)完全燃烧,C6H6(g)放热更多
6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ/mol
③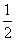 H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)===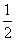 Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ/mo l
l
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+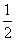 O2(g)===CO2(g) ΔH=-283 kJ/mol
O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l)
ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是______________________________________________________________________________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式
_________________________________________________________。
(3)上述反应中,表示燃烧热的热化学方程式有______________;表示中和热的热化学方程式有__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。
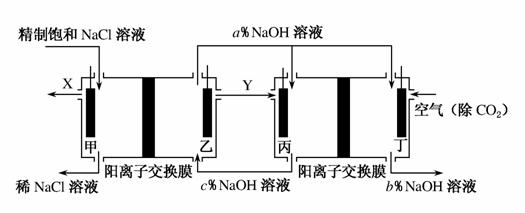
(1)为了有效除去粗盐中混有的Ca2+、Mg2+、SO ,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
,下列选项中所加试剂(均为溶液)及加入顺序均合理的是________(填选项字母)。
A.先加足量Ba(OH)2,再加足量Na2CO3,最后加入适量稀盐酸
B.先加足量NaOH,再加足量Na2CO3,然后加足量BaCl2,最后加入适量稀盐酸
C.先加足量Na2CO3,再加足量BaCl2,然后加足量NaOH,最后加入适量稀盐酸
D.先加足量Ba(NO3)2,再加足量NaOH,然后加足量Na2CO3,最后加入适量稀盐酸
(2)丙电极为________极,该电极的电极反应式为____________________________________。
(3)乙电极附近溶液的pH________(填“增大”“减小”或“不变”)。
(4)若装置中通过0.5 mol e-,则理论上生成标准状况下X的体积为________。
(5)图中NaOH溶液的质量分数a%、b%、c%由大到小的顺序为________。
(6)这样设计的主要节能之处在于(任写1条)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______,电子数为________。
(2)硅主要以硅酸盐、________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为_____________________________________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是
_______________________________________________________。
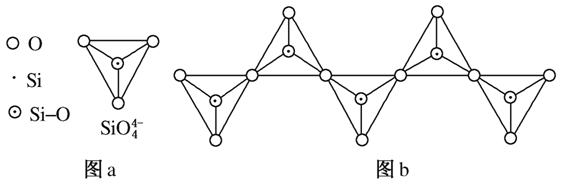
(6)在硅酸盐中,SiO 四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网
四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网 状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
状四大类结构型式。图b为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为________,Si与O的原子数之比为________,化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO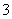 、SO
、SO 、Na+
、Na+
B.水电离出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO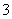
C.c(H+)/c(OH-)=1012的水溶液中:NH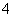 、Al3+、NO
、Al3+、NO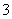 、Cl-
、Cl-
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂方案错误的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A. | CO(g) | CO2(g) | NaOH溶液、 浓H2SO4 | 洗气 |
| B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C. | Cl2(g) | HCl(g) | 饱和食盐水、 浓H2SO4 | 洗气 |
| D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com