
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
分析 (1)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,电极反应式为:O2+4e-+2H2O=4OH-;
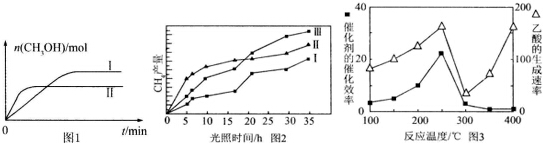
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,根据K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(CO)•{c}^{3}({H}_{2})}$判断;
②根据平衡三部曲求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
(4)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.由图2可知反应开始后的15小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多,Ⅲ次之,Ⅰ最少.
(5)①根据温度对催化剂活性的影响可知在300℃时失去活性,故得出乙酸的生成速率主要取决于温度影响的范围;
②先将Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,再根据氧化物与酸反应生成离子方程式,需要注意的是一价铜具有还原性;
解答 解:(1)Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
(2)CO燃料电池中,负极上是CO发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,电极反应式为:O2+4e-+2H2O=4OH-
,故答案为:O2+4e-+2H2O=4OH-;
(3)①Ⅱ比Ⅰ的甲醇的物质的量少,则一氧化碳和氢气的物质的量越多,根据K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(CO)•{c}^{3}({H}_{2})}$知,平衡常数越小,故KⅠ>KⅡ,故答案为:>;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始:1 3 0 0
平衡:1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)÷4=0.8
解得x=0.4mol
依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,故答案为:0.4<n(c)≤1mol;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ);故答案为:II>III>I;
(5)①温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,故以后乙酸的生成速率升高是由温度升高导致的,故乙酸主要取决于温度影响的范围为300℃~400℃,故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O•Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
点评 本题主要考查了化学反应常数、化学平衡以及原电池原理的运用,难度不大,根据所学知识即可完成.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al最外层电子数依次增多,单核离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强 | |
| C. | 同周期元素的原子半径以第ⅦA族的为最大 | |
| D. | Na、Mg、Al的氢氧化物的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂质在溶剂中的溶解度常温时很小,加热时很大 | |
| B. | 在室温时,产品在溶剂中易溶 | |
| C. | 产品在溶剂中的溶解度随温度升高而迅速增大 | |
| D. | 在同一溶剂中,产品比杂质易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 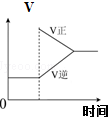 |  | 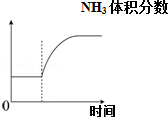 |
| 可逆反应:Cr2O72-+H2O?2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如图 | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42-(蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图 | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如图 | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
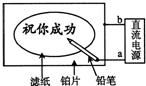 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com