
【题目】常温下,下列有关离子共存的说法中正确的是( )
A.某无色溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
B.在水电离出![]() 浓度为
浓度为![]()
![]() 的澄淸透明溶液中可能大量存在
的澄淸透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
C.小苏打溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
D.使甲基橙呈红色的溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3、SO42、Na+
B.存在较多Fe3+的溶液中:Na+、SCN、CO32、K+
C.常温下水电离出的c(H+)=10-12mol/L的溶液中::NH4+、Cl、CO32、F
D.在能使红色石蕊试纸变蓝色的溶液中:Na+、CO32、S2、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,结构简式为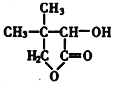 ,由(CH3)2C=CH2为原料合成G的路线如下:
,由(CH3)2C=CH2为原料合成G的路线如下:
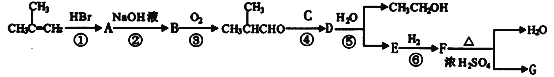
其中A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:(i). 
(ii).物质D的分子式为C8H14O4,能发生银镜反应
(iii).第⑤步反应条件为:H2O/H+,E的结构简式为: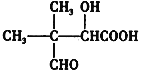
请回答下列问题:
(1)G物质中含有的官能团的名称为________,物质A的名称为________。(用系统命名法命名)
(2)第②步反应的反应类型为____________,物质D的结构简式为________。
(3)写出第③步反应的化学方程式____________________。
(4)同时满足下列条件的E的同分异构体共有____________种,其中核磁共振氢谱只有3组峰,且面积之比为3:1:1的结构简式为____________。
①只含有一种官能团;②链状结构且无-O-O-;③能与NaHCO3反应放出气体
(5)已知: 是一种重要的药物中间体,结合上述信息,请以
是一种重要的药物中间体,结合上述信息,请以![]() 和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L庚烷的分子数约为NA
B.1 L0.1mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
C.4.0 g![]() 与D2O的混合物中所含中子数为2NA
与D2O的混合物中所含中子数为2NA
D.50 mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:①适量HCl②适量NaCl③适量的氨水④适量的NaOH,正确的是
A. ①② B. ④ C. ③④ D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____。
A 质谱法 B 原子发射光谱法 C 核磁共振谱法 D X射线行射法
(2)第一电离能介于Al、P之间的第三周期元素有___种。GaCl3分子中心原子的杂化方式为___。
(3)基态As原子的核外电子排布式为_____,As原子的逐级电离能数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大_____________。
(4)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。

(5)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____,层与层之间的相互作用为_____。

(6)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____,每个As原子周围最近的As原子数目为_____,一个GaAs晶胞中配位键的数目为_____。

(7)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是
A. a=b=c B. a>b>c C. a>c>b D. c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀释Na2CO3溶液时,c(HCO3-)、![]() 均增大
均增大
B.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0
C.用0.1molL-1CH3COOH溶液滴定0.1molL-1NaOH至中性时:c(CH3COO-)+c(CH3COOH)=c(Na+)
D.向纯水中加入盐酸或氢氧化钠都能使水的电离平衡逆向移动,水的离子积减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com