
| A. | 汽车催化转化器中尾气处理反应的化学方程式为CO+NO$\frac{\underline{\;\;△\;\;}}{\;}$C+NO2 | |
| B. | 铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O | |
| C. | 加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2-、Cl- | |
| D. | pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42-、ClO- |
分析 A.反应生成氮气和二氧化碳;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液;
D.pH=0的溶液,显酸性,离子之间发生氧化还原反应.
解答 解:A.汽车催化转化器中尾气处理反应的化学方程式为2CO+2NO$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+N2,故A错误;
B.铁红溶于足量氢碘酸的离子方程式为Fe2O3+2I-+6H+═2Fe2++I2+3H2O,故B错误;
C.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中该组离子之间不反应,可能大量共存,故C正确;
D.pH=0的溶液,显酸性,Fe2+、ClO-发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.595g | B. | 1.42g | C. | 2.485g | D. | 2.72g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
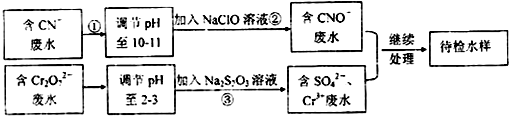
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度下水的离子积常数为Kw,在该温度下,a mol•L-1一元酸HA与b mol•L-1一元碱BOH等体积混合,溶液呈中性,则溶液中c(H+)=$\sqrt{Kw}$ | |
| B. | 已知MgCO3的Ksp=6.82×10-6mol2•L-2,则在含有固体MgCO3的Na2CO3溶液中,有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6mol2•L-2 | |
| C. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| D. | NH4Cl和NH3•H2O的混合溶液中,分别存在NH4+的水解平衡和NH3•H2O的电离平衡,二者对对方的平衡都起了促进作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

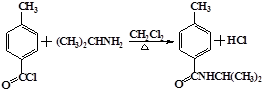 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
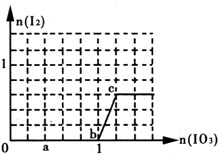
| A. | a点时消耗NaHSO3的物质的量为1.2 mol,得到的氧化产物为SO42- | |
| B. | b~c段的反应可用如下离子方程式表示:IO3-+5 I-+6H+═3I2+3H2O | |
| C. | 滴加过程中水的电离平衡一直逆向移动 | |
| D. | 从c点后所得混合液中分离出碘的操作为:加四氯化碳萃取分液,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X分别和其他四种元素均可形成至少2种化合物 | |
| B. | M、W、X、Y、Z的原子半径由大到小的顺序为Y>Z>X>W>M | |
| C. | X气态氢化物的稳定性大于Z态氢化物,但是X气态氢化物的沸点小于Z气态氢化物 | |
| D. | M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯可用作制食品包装袋的原料 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| D. | 含硫燃料燃烧产生的二氧化硫是形成酸雨的罪魁祸首 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com