
【题目】欲配制100mL 1.0mol/L Na2CO3溶液,正确的方法是( )
①将10.6g Na2CO3溶于100mL水中
②将28.6g Na2CO310H2O溶于少量水中,再用水稀释至100mL
③将20ml 5.0mol/L Na2CO3溶液用水稀释至100mL.
A.①②
B.②③
C.只有②
D.只有③
【答案】B
【解析】①10.6g Na2CO3的物质的量n(Na2CO3)= ![]() =0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出Na2CO3溶液的物质的量浓度,故①不符合题意;
=0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出Na2CO3溶液的物质的量浓度,故①不符合题意;
②28.6g Na2CO310H2O的物质的量n( Na2CO310H2O)= ![]() =0.1mol,则n(Na2CO3)=n( Na2CO310H2O)=0.1mol,Na2CO3溶液的物质的量浓度为
=0.1mol,则n(Na2CO3)=n( Na2CO310H2O)=0.1mol,Na2CO3溶液的物质的量浓度为 ![]() =1mol/L,故②符合题意;
=1mol/L,故②符合题意;
③溶液稀释前后溶质的物质的量不变,设稀释后溶液浓度为C,则20ml×5.0mol/L=100mL×C,解得C=1.0mol/L,故③符合题意;
所以答案是:B;
【考点精析】根据题目的已知条件,利用配制一定物质的量浓度的溶液的相关知识可以得到问题的答案,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水蒸气通过炽热的铁,生成Fe2O3和H2
B.用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝,该气体一定是Cl2
C.除去NO中混有的少量NO2 , 可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
D.反应MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O中,每析出12.8 g S共转移0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少汽车对城市大气的污染,我国成功地开发出以新燃料作能源的“绿色汽车”,这种汽车可避免有毒的有机铅、芳香烃等有害物质的排放,保护环境。这种“绿色汽车”的燃料是 ( )
A.甲醇
B.汽油
C.柴油
D.重油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B.1 mol Na2O2与CO2和水蒸气的混合气体完全反应,转移1 mol电子
C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D.a g CO和CH4的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成.Grignard试剂的合成方法是:RX+Mg ![]() RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂).生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: 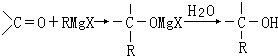
现以2﹣丁烯和必要的无机物为原料合成3,4﹣二甲基﹣3﹣己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种.
请按要求填空:
(1)D中官能团的名称为;F的结构简式是 .
(2)C+D→E的反应类型是 , F→G的反应类型是;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J ,
(4)化合物G在一定条件下发生加聚反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年4月22日是第44个“世界地球日”。我国的主题是“珍惜地球资源,转变发展方式——促进生态文明 共建美丽中国”。下列说法中与“世界地球日”的主题无关的是 ( )
A.减少CO2的排放量,以降低温室效应对地球的影响
B.开发利用太阳能、水力发电等无污染能源
C.燃料脱硫以减少酸雨的产生
D.我国政府已向全世界承诺:在全国消灭碘缺乏病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种化工原料和溶剂,在科研和生产中应用广泛.请回答下列问题.
(1)苯易挥发且有 , 所以苯在油漆中用作溶剂不符合绿色化学的基本原则.
(2)往盛有3mL溴水的试管中加入2mL苯,充分振荡、静置分层后,颜色较深的是(填“上”或“下”)层.
(3)苯分子中6个碳原子连接成平面正六边形结构,6个碳原子间的共价键完全相同.由此推测,苯分子中任意相邻2个碳原子间平均共用的电子个数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是()
A. 体系的压强 B. 反应物的浓度
C. 正、逆反应速率 D. 反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X,含有Fe3+、Fe2+、Ba2+、Al3+、NH4+、CO32﹣、SiO32﹣、SO42﹣、NO3﹣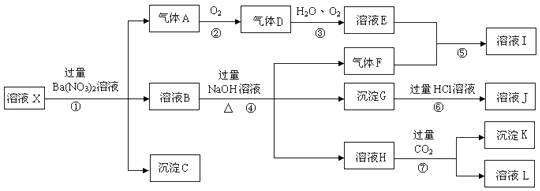
依据以上信息,回答下列问题:
(1)写出步骤①生成气体A的离子方程式 .
(2)气体F的电子式为 , 实验中,可以观察到反应②的现象是: .
(3)检验溶液I中存在的阳离子的方法是 .
(4)沉淀G的化学式为;写出反应⑦的化学方程式 .
(5)溶液X中肯定存在的离子有 , 可能存在的离子有 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com