
��12�֣���������������Ҫ�ɷ�ΪFe2O3��Fe3O4���Լ�����SiO2��Al2O3�ȡ��������������Ʊ����죨Fe2O3����һ�ֹ����������£�

��֪����ԭ����ʱ����Fe2O3��Fe3O4ת��ΪFeO��
�������ӿ�ʼ��������ȫ����ʱ��pH���±���ʾ��
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
��1������������ˡ�������������Һ�еĽ����������У������ӷ��ţ���
��2��Fe�۳���pH�⣬��һ�������ǣ�Fe�۵�����Һ��pHΪ��
��3�������������ˡ�����������FeCO3�����ӷ���ʽΪ��
������Һ����Ҫ�����ǣ��ѧʽ����
��4�����������£��������������з�����Ӧ�Ļ�ѧ����ʽΪ��
��1��Fe2+��Fe3+��Al3+����2������Һ��Fe3+��ԭΪFe2+��������Al3+���룻5��4.7��7.6����֮���������ֵ������3��Fe2++2HCO3-=FeCO3��+CO2��+H2O��(NH4)2SO4����4��FeCO3+O2 2Fe2O3+4CO2
2Fe2O3+4CO2
��������
����������������������к���Fe2O3��Fe3O4���Լ�����SiO2��Al2O3�ȣ���������ʱ��Fe2O3��Fe3O4��Al2O3������Ӧ��ΪFe2+��Fe3+��Al3+��������Һ�У���SiO2�����ܽ������У������˳�ȥ����2������Fe3+��Al3+�γɳ���ʱ����Һ��pH�ӽ����������룬���Լ���Fe�۳���pH�⣬��һ�������ǽ���Һ��Fe3+��ԭΪFe2+��������Al3+���룻����Al3+������ȫ����Һ��pH=4.7,��Fe2+������ȫ����Һ��pH=9.7,����Fe�۵�����Һ��pHΪ4.7��7.6����֮���������ֵ����3�����������ڡ����������ˡ�����������FeCO3�����ӷ���ʽΪFe2++2HCO3-=FeCO3��+CO2��+H2O�������ڹ����м�����������NH4HCO3,����������Һ����Ҫ������(NH4)2SO4����4�����������£�FeCO3 ��O2 ������Ӧ����Fe2O3��CO2�����ݵ����غ��Ԫ�ص�ԭ�Ӹ����غ�ɵøá������������з�����Ӧ�Ļ�ѧ����ʽΪFeCO3+O2 2Fe2O3+4CO2��
2Fe2O3+4CO2��
���㣺�������ʵ����ʡ�ת������Ӧ�����Ŀ�����ѡ����ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�����ظ߶���ѧ�����е��в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
2007���ŵ������ѧ���������������о��ϳɰ�������������С��ϵ�ĵ¹���ѧ�Ҹ����?���ض����������ڡ�������滯ѧ���̡��о��������Ĺ��ס�����˵������ȷ����
A����ҵ�����У��ϳɰ�����ѹǿԽ�ߣ��¶�Խ�ͣ�Խ��������߾���Ч�档
B����������ı�������ܼӿ�ϳɰ�������Ӧ���ʡ������淴Ӧ����
C�����ô���ʱ����Ӧ�Ļ�ܽ��ͣ�ʹ��Ӧ�״����̬�������Լӿ�
D����������ı���������������IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�߶���ѧ��4�½β��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�˵����ȷ����
A��NH4Cl(s)��NH3(g)+HCl(g)�����²����Է����У�˵���÷�Ӧ�Ħ�H��0
B����п����Ʒ�Ʋ����������Ʒ������ǰ���������⣬�����������෴
C������N2(g)+3H2(g) 2NH3(g)����������������ʱ��ѹ���������ʹѹǿ��������Ӧ���淴Ӧ�����Լ�H2��ƽ��ת���ʾ�����
2NH3(g)����������������ʱ��ѹ���������ʹѹǿ��������Ӧ���淴Ӧ�����Լ�H2��ƽ��ת���ʾ�����
D��100��ʱˮ�����ӻ�����KwΪ5��5��10��13��˵��ˮ�ĵ����Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ������ѧ�������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A����ҵ��ⱥ��ʳ��ˮ��2Cl��+ H2O = Cl2��+ H2��+ OH��
B��̼���Ƶ�ˮ��������
CO32��+ 2H2O H2CO3 + 2OH��
H2CO3 + 2OH��
C����������Һ�еμӹ���Ũ��ˮ��Al3����4 NH3��H2O===AlO ��4NH4����2H2O
��4NH4����2H2O
D���ù���������ữ�����ҽ���Һ����ȡ�⣺2I��+ H2O2 +2H+ = I2 +2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ʵ����
[ʵ�黯ѧ]���Ǽ�����ͪ�׳Ʋ��ͪ������ɫ��״���壬�۵�58�棬�е�208�棨3.3kp�����������ѡ��ȷºͱ������ڴ����Ʊ�ԭ�����£�
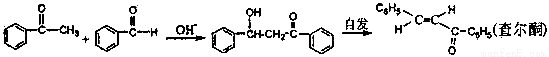

��1���Ʊ������С����ڽ����µμӱ����ᣬ�����Ƶμ��ٶ�ʹ��Ӧ�¶�ά����25~30�棬˵���÷�Ӧ�ǣ�����ȡ������ȡ�����Ӧ�����¶ȹ���ʱ����ɲ��� ��ʩ��
��2����Ʒ�ᾧǰ�����Լ��뼸����Ʒ�IJ��ͪ���������ǡ�
��3���ᾧ��ȫ��������ռ����������װ������������������ѹϵͳ��С������������ƣ���
��4����õ���ɫ�ֲ�Ʒ�������̿����95%�Ҵ��ؽᾧ���ò��ͪ���壬��ͨ�������ж�ԭ���Ƿ�Ӧ��ȫ�Լ���Ӧ��ת���ʺ�ѡ���ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���ǣ���
A�������£�ij�������KspΪ2.5��105
B����ͭ����Ʒ�Ʋ����������Ʒ������ǰ����������
C��NH3��H2O��Һ��ˮϡ�ͺ���Һ��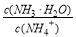 ��ֵ����
��ֵ����
D�������£�pH��Ϊ5���������Ȼ����Һ�У�ˮ�ĵ���̶���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й�������������Ӧ�õ�˵����ȷ���ǣ���
A��̼���л�ԭ�ԣ������������ܽ��������軹ԭΪ��
B������������Ư�ס�ɱ�����ܣ�����ʳƷ�ӹ��д���ʹ��
C�����������ǰ뵼����ϣ��ɽ�̫����ֱ��ת��Ϊ����
D���������̾��н�ǿ�ĵ������ԣ�����H2O2�ֽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ�����ӵ�����������˵����ȷ����
A��18g D2O���еĵ�����Ϊ10NA��
B��1mol Na2O2��ˮ��ȫ��Ӧʱת�Ƶ�����Ϊ2NA ��
C��12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA��
D��200mL1mol/LFe2(SO4)3��Һ�У�Fe3+��SO42�����������ܺ���NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com