
 .
.分析 (1)NaCN为离子化合物,CN-中各原子均满足8电子稳定结构,存在C≡N键;
(2)25℃时,HCN的电离常数Ka=6×10-19,NaA中水解平衡常数Kb=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6×1{0}^{-19}}$>6×10-19,说明HA的电离程度小于水解程度,结合电荷守恒、物料守恒等知识解答该题.
解答 解:(1)CN-中各原子均满足8电子稳定结构,存在C≡N键,电子式为 ,故答案为:
,故答案为: ;
;
(2)将0.2mol•L-1HCN溶液与0.1mol•L-1NaOH溶液等体积混合,得到等浓度的HCN、NaCN,NaA中水解平衡常数Kb=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6×1{0}^{-19}}$>6×10-19,说明HA的电离程度小于水解程度,NaCN为强碱若酸盐,水解呈碱性,离子方程式为CN-+H2O?HCN+OH-,所以溶液呈碱性,等体积混合后,体积为原来体积的2倍,根据物料守恒得①c(HCN)+c(CN-)=0.1mol•L-1,溶液中存在电荷守恒②c(CN-)+c(OH-)=c(Na+)+c(H+),①-②得:c(HCN)+c(H+)-c(OH-)=0.1mol•L-1-c(Na+)=0.1mol•L-1-0.05mol•L-1=0.05mol•L-1,
故答案为:碱性;0.05.
点评 本题考查了弱电解质的电离和盐类水解,明确Ka、Kb、Kw之间的关系以及HCN电离程度与CN-水解程度相对大小是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
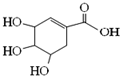
| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10与12 | B. | 8与17 | C. | 19与17 | D. | 6与14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x个 | B. | $\frac{x}{4}$个 | C. | $\frac{2x}{3}$个 | D. | $\frac{x}{2}$个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向H2S水溶液中加入NaOH有利于S2-增多 | |
| B. | 鼓入过量空气有利于SO2转化为SO3 | |
| C. | 高压对合成氨有利 | |
| D. | 500℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com