
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.O2和O3共32 g混合物中氧原子的个数为2NA
B.78 g苯含有C=C 键的数目为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.足量Fe与1 mol 氯气反应时转移的电子数为3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g) CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的
情况下
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
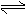 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

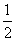 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 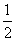 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
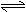 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。

A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
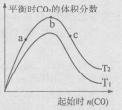
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g)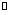 HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
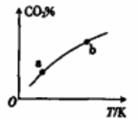
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为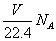
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
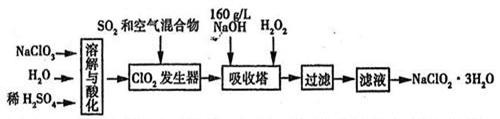
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性 B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450ml
l60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,
所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3) 吸收塔内的温度不能超过20℃,其主要目的是 _,吸收塔内发生反应的化学方程式为 。
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
A.蒸馏 B.蒸发浓缩 C.灼烧 D.过滤 E、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25。C时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A. 盐类都能水解
B. 配制FeCl3溶液,为了抑制水解,常加入盐酸
C. 盐类的水解反应,通常是吸热反应
D. 盐类水解是指组成盐的离子跟水电离出来的H+或OH—生成弱电解质的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
A.在0~50 min之间,pH=2和pH=7时R的降解
百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20~25 min之间, pH=10时R的平均降解速率为
0.04 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com