
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
分析 X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,原子核外电子排布式为1s22s22p2,故X为C元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,故W为Cu,据此解答.
解答 解:X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,原子核外电子排布式为1s22s22p2,故X为C元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为S元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl;W的一种核素的质量数为63,中子数为34,质子数为63-34=29,故W为Cu.
(1)Y的元素符号是S,故答案为:S;
(2)CS2是一种常用的溶剂,结构与CO2类似,结构式为S=C=S,含有2个σ键;在H-S、H-Cl两种共价键中,Cl元素的电负性更大,对键合电子的吸引力更强,故H-Cl键的极性较强,键长取决于中心元素的原子半径,中心原子的原子半径越大,则键长越长,S原子半径大于Cl原子,所以H-Cl键长小于H-S键长,
故答案为:2;H-Cl;H-S;
(3)W为Cu元素,原子核外电子数为29,基态原子核外电子排布为1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(4)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质硫.此反应的化学方程式是2CO+SO2=S+2CO2,
故答案为:2CO+SO2=S+2CO2;
(5)设计实验方案,比较S、氯气氧化性的强弱:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强,
故答案为:在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强.
点评 本题考查结构性质位置关系应用,涉及核外电子排布、化学键、氧化性比较等,难度不大,推断元素是解题关键,注意基础知识的全面掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | 聚乙烯塑料制品可用于食品的包装 | |
| C. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| D. | 氧化铝是冶炼金属铝的原料,也是一种较好的耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
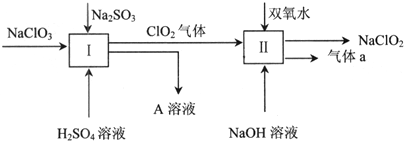
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
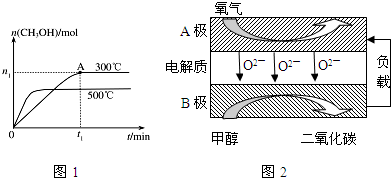
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com