
科目:高中化学 来源: 题型:单选题
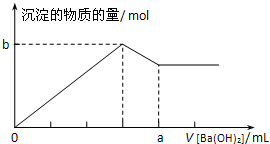 已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是
已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| ______ | ______ |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
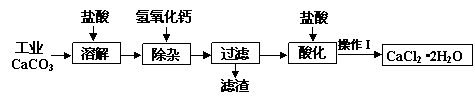
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com