
| 实验步骤和结论(不要求写具体操作过程): |
分析 (1)NaCl溶液为中性,发生吸氧腐蚀,Fe为负极,正极上氧气得电子;
(2)②向饱和Na2S溶液中滴加0.1mol•L-1K3[Fe(CN)6]溶液时,由信息可知,发生氧化还原反应;甲同学设计的方案中负极生成的Fe2+与K3[Fe(CN)6]溶液反应会生成蓝色物质;
(3)用煮沸后的蒸馏水配制K3[Fe(CN)6]溶液,赶走溶解在溶液中的氧气;铁丝反复打磨除去表面的氧化膜;
(4)Fe2+具有还原性,结合铁离子与KSCN溶液结合得到血红色溶液可检验.
解答 解:(1)NaCl溶液为中性,发生吸氧腐蚀,Fe为负极,正极上氧气得电子,正极反应为O2+2H2O+4e-=4OH-,故答案为:吸氧; O2+2H2O+4e-=4OH-;
(2)②向饱和Na2S溶液中滴加0.1mol•L-1K3[Fe(CN)6]溶液时,由信息可知,发生氧化还原反应生成S单质,则观察到的现象为有黄色浑浊出现;甲同学设计的方案中负极上Fe失去电子生成的Fe2+与K3[Fe(CN)6]溶液反应会生成蓝色物质,也可能为铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色物质,
故答案为:有黄色浑浊出现;铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,产生的Fe2+再与K3[Fe(CN)6]反应生成蓝色物质;
(3)丙同学在实验中用煮沸后的蒸馏水配制K3[Fe(CN)6]溶液的目的是赶走溶解在溶液中的氧气(或空气);铁丝反复打磨的原因是除去表面的氧化膜,
故答案为:赶走溶解在溶液中的氧气(或空气);除去表面的氧化膜;
(4)实验方案验证有Fe2+生成,实验步骤和为取2mL左右的苯于试管中,从铁电极处吸取少量待测液伸入苯层下方挤出,并依次加入0.1 mol•L-1KSCN溶液、30%H2O2溶液,观察实验现象,结论为若滴入KSCN溶液无红色出现,滴入H2O2溶液后出现红色,则证明铁电极处产物为Fe2+,
故答案为:取2mL左右的苯于试管中,从铁电极处吸取少量待测液伸入苯层下方挤出,并依次加入0.1 mol•L-1KSCN溶液、30%H2O2溶液,观察实验现象,若滴入KSCN溶液无红色出现,滴入H2O2溶液后出现红色,则证明铁电极处产物为Fe2+.
点评 本题考查以原电池原理考查物质组成及性质实验的设计,为高频考点,把握电极反应、氧化还原反应及离子检验等为解答的关键,侧重分析与实验能力的考查,注意本题属于开放性试题,能较好训练学生分析解答问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
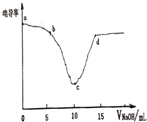 电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )
电导率可用于衡量电解质溶液的导电能力,即电导率越大,则溶液的导电能力越强.利用电导率传感器测得用0.100mol/L的NaOH溶液滴定10.00mL0.100mol/L的盐酸,电导率曲线如图所示.下列说法不正确的是( )| A. | d点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| B. | 电导率传感器能用于酸碱中和滴定终点的判断 | |
| C. | c点电导率最小是因为c点溶液的溶质为弱电解质 | |
| D. | c(Na+)、c(Cl-)对导电能力的影响比c(H+)、c(OH-)对导电能力的影响小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(NO3)2溶液中通入CO2不产生白色沉淀,则通入SO2也不产生白色沉淀 | |
| B. | 电负性:C<N<O,则第一电离能:C<N<O | |
| C. | 乙醛能被新制Cu(OH)2氧化,则乙醛也能被溴水氧化 | |
| D. | HBr的沸点小于HI的沸点,则HBr的稳定性小于HI的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com