
| A、2.3克金属钠变为钠离子失去的电子数目为0.1NA |
| B、18克水所含有的电子数目为NA |
| C、在常温常压下,11.2L氯气所含的原子数目为NA |
| D、2.8克氯气和一氧化碳混合气体的原子数目为0.2NA |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、二氧化碳分子中存在共价键和分子间作用力 |
| B、甲烷、氨和水都是由极性键结合而成的极性分子 |
| C、同主族不同元素的最高价氧化物,一定具有相同的晶体结构 |
| D、氟化氢的沸点高于氯化氢的沸点,正丁烷的沸点高于异丁烷的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
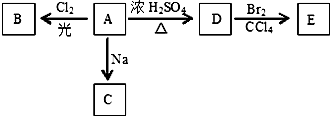
查看答案和解析>>
科目:高中化学 来源: 题型:
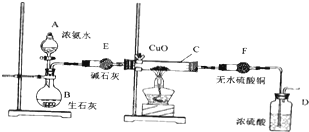
查看答案和解析>>
科目:高中化学 来源: 题型:

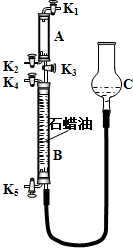
查看答案和解析>>
科目:高中化学 来源: 题型:
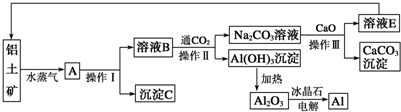
| ||
| 通电,Na3AlF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 | 0.089 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com