
| A. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| B. | 氢铝化合物中铝显+3价,氢显-1价 | |
| C. | 铝与水蒸气高温下反应生成氢铝化合物 | |
| D. | 氢铝化合物具有强还原性 |
分析 氢铝化合物性质不稳定能和水反应生成氢氧化铝和氢气,在氧化还原反应中氢铝化合物体现还原性;在化合物中电负性大的显负价,电负性小的元素显正价,据此解答.
解答 解:A.氢铝化合物中氢元素显负价,性质不稳定,易和水反应生成氢氧化铝和氢气而体现还原性,故A正确;
B.在化合物中电负性大的显负价,电负性小的元素显正价,氢元素的电负性大于铝元素,氢铝化合物中铝元素显+3价,氢元素显-1价,故B正确;
C.氢铝化合物易和水反应,所以不能用铝和水蒸气反应制取氢铝化合物,故C错误;
D.氢铝化合物中氢元素显-1价,性质不稳定,易失电子而具有强还原性,故D正确;
故选C.
点评 本题以铝为载体考查铝的化合物的性质,根据元素电负性、元素化合价和性质的关系来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H﹦+1.9kJ•mo1-1,说明金刚石具有的能量比石墨低 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(1)△H﹦-57.4KJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ•mo1-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H﹦-890.3kJ•mo1-1 | |
| D. | 将0.5mo1N2和1.5mo1H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H﹦-38.6kJ•mo1-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
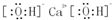 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
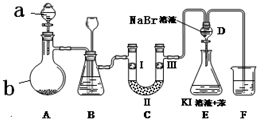 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | (1) | (2) | (3) | (4) |
| 反应速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com