
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |

(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的是________,氧化性最强的单质是________, 还原性最强的单质是________;
还原性最强的单质是________;
(2)最高价氧化物的水化物中碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A与H形成________化合物(填“离子”或“共价”),用电子式表示它的形成过程________________________________________;B与G形成________化合物(填“离子”或“共价”),用电子式表示它的形成过程_______________________;
科目:高中化学 来源: 题型:
Fe、C、N、O、H可以组成多种物质。回答以下问题:
(1)基态铁原子中,未成对电子数有 个。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基
铁[Fe(CO)5],其结构如右图。已知CO分子与N2分子结构相
似,分子中C、O原子均能提供孤电子对形成配位键。
①CO分子中σ键与π键数目之比为 ;
②从电负性角度分析,Fe(CO)5中与Fe形成配位键的是 (填“碳”或“氧”)原子。
 ③与羰基铁分子的极性相似的分子是 。
③与羰基铁分子的极性相似的分子是 。
A.SO2 B.CS2 C.BF3 D.PCl3
(3)CH4、H2O分子的键角分别为a、b。则a b
(填>、=或<),原因是 。
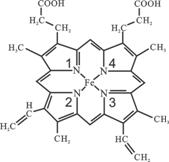
(4)血红素分子结构如右图所示。
①血红素分子间存在的作用力有 (填名称);
②与Fe通过配位键结合的氮原子的编号是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
砹(At)是卤素中核电荷数最大的元素,下列推测中错误的是 ( )
A. 砹为有色固体 B. AgAt不溶于水
C. HAt 很稳定 D. 砹单质熔沸点比碘单质熔沸点高
很稳定 D. 砹单质熔沸点比碘单质熔沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表和元素周期律的说 法正确的是 ( )
法正确的是 ( )
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而减少
B.因为K比Na容易失去电子,所以K比Na的还原性强
C.第二周期元素从Li到F,非金属性逐渐减弱
D.O与S为同主族元素,且O比S的非金属性弱
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年世界环境日,中国提出的主题为“绿色奥运与环境友好型社会”。爱护环境,呵护地球是我们每一个人不可推卸的责任。下列大气污染现象与污染源对应不正确的是( )
A.酸雨——硫的氧化物、氮的氧化物
B.光化学烟雾——碳氢化合物、氮的氧化物
C.臭氧空洞——氟氯烃(即氟利昂) D.温室效应——SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
化学工艺中倡导无污染的绿色化学是一场新的技术革命。若使用单质铜制硝酸铜,下列方案中,耗用原料最经济,而且对环境几乎没有污染的是( )
A.Cu和稀硝酸反应制Cu(NO3)2
B、Cu和浓硝酸反应制Cu(NO3)2
C、铜在空气中受热转化为CuO,再溶于稀硝酸制Cu(NO3)2
D、铜在氧气中受热转化为CuO,再溶于浓硝酸制Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;B是短周期中非金属性最强的元素;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A______,B______,E______。
(2)画出E的原子结构示意图______。
(3)比较EA2与EB4的熔点高低(填化学式)______>______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点______(填“高”或“低”),原因是______________________________。
(5) 写出电子式D2A2______,EB4______。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有如图所示A、B、C、D四种仪器:
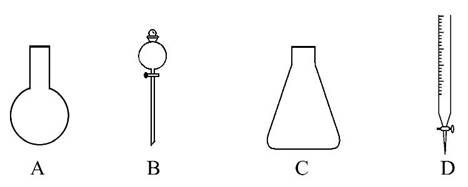
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②碱式滴定管 ③圆底烧瓶 ④锥形瓶
⑤分液漏斗 ⑥酸式滴定管
A________,B________,C________,D________。
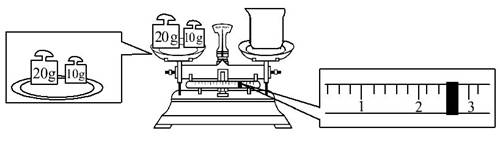
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图可以看出,该同学在操作时的一个错误是______________。
烧杯的实际质量为________g。
(3)指出下面三个实验中各存在的一个错误:
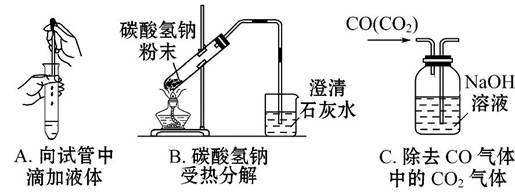
A______________________________________________________________;
B______________________________________________________________;
C______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com