
 酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.分析 (1)反应中KMnO4中Mn元素化合物由+7价降低为MnO2中+4价,C元素的化合价升高,结合电子、原子守恒配平;
(2)KMnO4在酸性条件下氧化性增强,在稀硫酸中将乙醇氧化为乙酸,Mn元素被还原为较低价态的Mn2+;
(3)五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,用淀粉检验碘的生成,反应有碘生成;
(4)酸性燃料电池中,负极上乙醇失去电子,正极上氧气得到电子;
(5)根据氧化剂氧化性强于氧化产物的氧化性判断.
解答 解:(1)反应中KMnO4中Mn元素化合物由+7价降低为MnO2中+4价,C元素的化合价升高,由电子及原子守恒可知,反应为3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O,
故答案为:3;2;3;2;2;2;
(2)KMnO4在酸性条件下氧化性增强,在稀硫酸中将乙醇氧化为乙酸,Mn元素被还原为较低价态的Mn2+,故还原产物为MnSO4,12.0mg乙酸的物质的量为$\frac{0.012g}{60g/mol}$=2×10-4mol,反应中C元素化合价由乙醇中的+2升高为乙酸中0价,故转移电子为2×10-4mol×2×(2-0)=0.0008mol,
故答案为:MnSO4;0.0008mol;
(3)五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,用淀粉检验碘的生成,反应有碘生成,反应方程式为I2O5+5CH3CH2OH→I2+5CH3CHO+5H2O,
故答案为:I2O5+5CH3CH2OH→I2+5CH3CHO+5H2O;
(4)酸性燃料电池中,负极上乙醇失去电子,负极反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+,正极上氧气得到电子,正极反应为O2+4e-+4H+=2H2O,
故答案为:CH3CH2OH-4e-+H2O=CH3COOH+4H+;O2+4e-+4H+=2H2O;
(5)反应中氧气是氧化剂,乙醇是还原剂,乙醛是氧化产物,过氧化氢是还原产物,氧化剂的氧化性强于氧化产物的氧化性,也强于还原剂、还原产物的氧化性,故氧气的氧化性最强,故答案为:O2.
点评 本题考查较综合,涉及氧化还原反应的计算与配平、氧化还原反应的应用及原电池等,综合性较强,侧重分析与迁移应用能力及高频考点的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,6一二甲基萘 | B. | 2,5一二甲基萘 | C. | 4,7一二甲基萘 | D. | 1,6一二甲基萘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | PX项目的主要产品对二甲苯属于饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
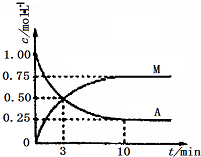 已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:A(g)+3B(g)?M(g)+N(g);△H=-49.0kJ•mol-1.一定条件下,向体积为2L的密闭容器中充入2mol A和6molB,测得A和M的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 充分反应后该反应放出98 kJ的热量 | |
| B. | 10min后,升高温度能使$\frac{n(M)}{n(A)}$增大 | |
| C. | 3min时B的生成速率是M生成速率的3倍 | |
| D. | 反应到达平衡时刻B的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
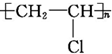 单体为CH2═CH-Cl.
单体为CH2═CH-Cl.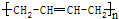 单体为CH2═CH-CH═CH2,
单体为CH2═CH-CH═CH2,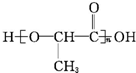 单体为
单体为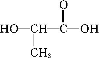 ,
,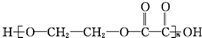 单体为HO-CH2CH2-OH和HOOC-COOH.
单体为HO-CH2CH2-OH和HOOC-COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 50mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23 g钠充分燃烧时转移电子数为1 NA | |
| D. | 235 g核素${\;}_{92}^{239}$U发生裂变反应:${\;}_{92}^{239}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 途径①反应中体现了浓HNO3的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 | |
| C. | 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- | |
| D. | 途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN是钠盐 | B. | 氰化氢的酸性比碳酸的强 | ||
| C. | NaCN是强电解质 | D. | CN-有剧毒性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com